Nous expliquons ce qu’est l’acide sulfurique, à quoi ressemble sa formule et les propriétés qu’il possède. Aussi, quelles sont ses caractéristiques et ses utilisations.

Qu’est-ce que l’acide sulfurique ?
L’acide sulfurique est un composé chimique hautement corrosif . C’est l’un des produits chimiques les plus générés et les plus utilisés au monde, compte tenu de ses nombreuses applications dans l’industrie et dans la synthèse d’autres intrants chimiques.
Il est connu sous le nom d’acide tétraoxosulfurique (VI) ou de tétraoxosulfate d’hydrogène (VI). Et il est composé d’un atome de soufre , deux d’ hydrogène et quatre d’ oxygène . Il est représenté par la formule moléculaire H 2 SO 4 .
Voir aussi: Acide chlorhydrique
Histoire de l’acide sulfurique
L’acide sulfurique a été observé pour la première fois au Moyen Âge musulman, lorsque les alchimistes l’ont obtenu à partir de cristaux de sels de sulfate , un matériau qu’ils connaissaient sous le nom de vitriol, du latin vitreus (« cristal »). Pour cette raison, l’acide sulfurique était traditionnellement appelé huile de vitriol, liqueur de vitriol ou esprit de vitriol.
Selon cette tradition, le vitriol était censé être le produit chimique le plus important au monde , il pouvait donc être utilisé comme pierre philosophale (une substance censée pouvoir convertir les métaux en or ou en argent ). Pour cette raison, diverses substances étaient appelées vitriol bleu ou romain ( sulfate de cuivre II, CuSO 4 ), vitriol blanc ( sulfate de zinc , ZnSO 4 ), vitriol vert ( sulfate de fer II, FeSO 4 ), vitriol rouge (sulfate de zinc, cobalt II , CoSO 4 ) et le vitriol de Mars (sulfate de fer III, Fe 2 (SO 4 ) 3 ).
La première production d’acide sulfurique dans le monde moderne a eu lieu au 17ème siècle. L’Allemand Johann Glauber l’a obtenu en brûlant du soufre avec du nitrate de potassium (KNO 3 ). Sa fabrication formellement reconnue a eu lieu au 18ème siècle en Angleterre , selon une méthode connue sous le nom de « chambres de plomb ».
Cette méthode consistait à laver le dioxyde de soufre gazeux chaud (SO 2 ) en divers composés azotés. Il a ensuite été dissous dans un bain acide pour former l’acide de tour ou l’acide de Glover.
Ce dernier passait ensuite dans une série de chambres de plomb dans lesquelles il était lavé à l’eau , puis bouilli et condensé sur les parois. Il s’agissait cependant d’une très faible concentration d’ acide par rapport aux autres méthodes actuelles.
Propriétés de l’acide sulfurique

Propriétés physiques
- L’acide sulfurique est un liquide huileux incolore avec une odeur particulière selon sa concentration. Il a un point de fusion de 10 °C et un point d’ébullition de 337 °C.
- Sa densité est de 1,84 g/cm 3 . Il est miscible (soluble) avec l’eau, mais génère de la chaleur, compte tenu de son énorme effet déshydratant.
- Il est très polaire et conduit très bien le courant électrique .
Propriétés chimiques
- C’est un oxydant puissant.
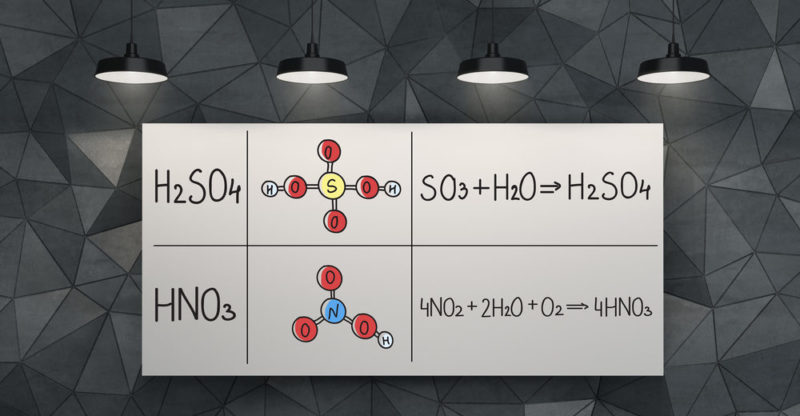
- Il réagit avec les métaux ordinaires, tels que l’aluminium , pour former des sulfates et des bisulfates, ainsi que pour libérer de l’hydrogène.
- Lorsqu’il est concentré et à haute température, il réagit avec le carbone , le phosphore et le soufre. De plus, dans cette variante, il peut également réagir avec des métaux précieux.

- Décompose les sels formés par d’autres acides.
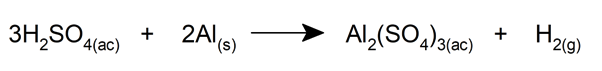
Structure chimique de l’acide sulfurique
La molécule d’acide sulfurique a une structure pyramidale , avec l’ atome de soufre au centre et les quatre atomes d’oxygène qui lui sont attachés, situés à quatre sommets. Deux des atomes d’oxygène sont liés au soufre par des doubles liaisons, tandis que les deux autres par des liaisons simples. Dans deux d’entre eux, les deux atomes d’hydrogène sont également joints.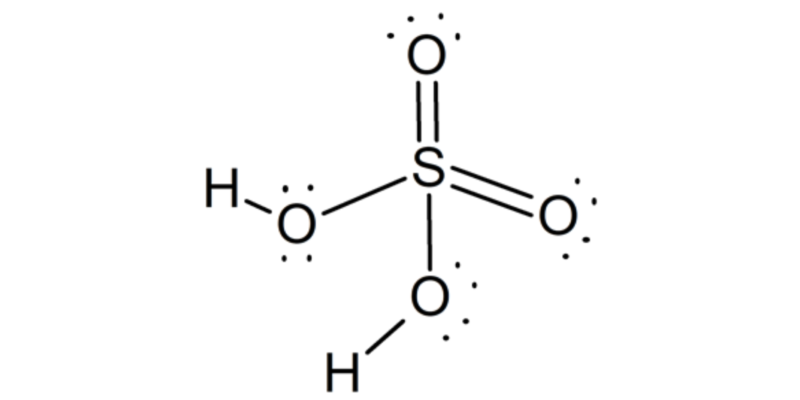
Comment l’acide sulfurique est-il obtenu ?

L’acide sulfurique est couramment obtenu à partir des méthodes suivantes :
Méthode de contact
Premièrement, le dioxyde de soufre (SO 2 ) est obtenu par la combustion du soufre avec de l’oxygène ou par grillage de minéraux comme la pyrite. Le dioxyde de soufre est ensuite oxydé pour obtenir du trioxyde de soufre (SO 3 ).
Le trioxyde de soufre passe ensuite dans des mécanismes de refroidissement puis dans une tour d’absorption, où il réagit avec un échantillon d’acide sulfurique concentré, ce qui donne de l’acide pyrosulfurique (H 2 S 2 O 7 ) .
Cet acide est ensuite décomposé par sa réaction avec l’eau , ce qui donne deux fois plus d’acide sulfurique. Cette chaîne de réactions est décrite comme suit :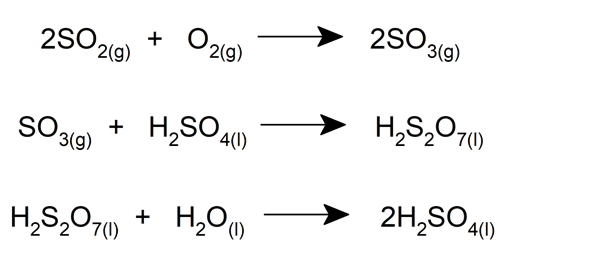
Notez qu’il n’est pas pratique de diluer le trioxyde de soufre directement dans l’eau , car il génère une réaction exothermique si violente que la majeure partie du composé se volatilise avant que la formation d’acide sulfurique ne puisse se produire.
Méthodes de chambre de plomb
L’acide sulfurique utilisé pour fabriquer des engrais est principalement produit par cette méthode.
Dans ce processus, le dioxyde de soufre pénètre à haute température par le bas d’une tour Glover (un type de réacteur chimique), où il est lavé avec une solution de monoxyde d’azote (NO) et de dioxyde d’azote (NO 2 ) dans de l’acide sulfurique. Au cours de ce processus, une partie du dioxyde de soufre est oxydée en trioxyde de soufre, qui est lavé à l’acide pour former l’acide de Glover, un acide qui se forme dans la tour et qui contient 78 % de H 2 SO 4 .
Le mélange est ensuite passé dans une chambre de plomb , où il est traité avec de l’eau et de l’acide sulfurique se condense sur les parois de la chambre.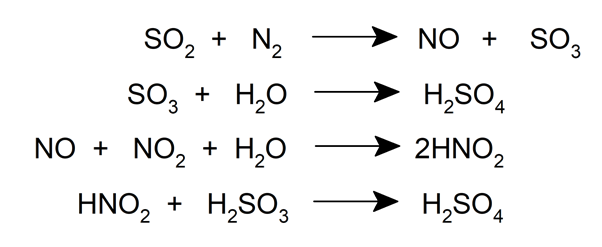
A quoi sert l’acide sulfurique ?

Les applications de l’acide sulfurique se situent principalement dans l’ industrie chimique et pétrochimique , dans le cadre de l’obtention d’autres acides et bases. Il est particulièrement important dans l’industrie des engrais, ainsi que dans le raffinage du pétrole , le traitement de l’ acier , la fabrication d’explosifs, de détergents et de plastiques .
Son importance dans l’ industrie du bois et du papier est également connue . Elle est également impliquée dans de nombreux processus de l’industrie textile et dans la production de batteries. Dans de nombreux pays, sa vente fait l’objet d’une surveillance stricte puisqu’il fait partie des produits chimiques couramment utilisés dans la fabrication de la cocaïne.
Toxicité de l’acide sulfurique
Il est clair que l’acide sulfurique est un composé toxique : un irritant majeur , capable de corroder rapidement les matières organiques, lorsqu’il est présent à fortes concentrations.
Même à faible concentration, des expositions répétées peuvent provoquer des dermatites voire des cancers. Il n’y a pas de niveaux sûrs d’inhalation, d’ingestion ou d’exposition par contact pour ce composé.
Commercialisation de l’acide sulfurique

L’acide sulfurique est le produit chimique le plus fabriqué au monde et ses ventes sur toute la planète sont importantes. A tel point qu’à un certain moment leurs marges de production ont été utilisées comme méthode de mesure du degré d’ industrialisation des pays.
Le prix au kilogramme peut aller de dizaines à des centaines de dollars américains, selon sa concentration.
Contamination de l’environnement par l’acide sulfurique
L’acide sulfurique ne se trouve généralement pas dans la nature , encore moins à des concentrations élevées. Par conséquent, il constitue un composé polluant avec un grand impact sur la vie animale et végétale , surtout compte tenu de sa réaction explosive avec l’eau.
Les déversements de matériaux sont généralement traités avec une base solide (comme le bicarbonate) et contenus à l’aide de cendres de ciment ou d’autres matériaux résistants . Il ne doit jamais être tenté de le diluer avec de l’eau , ni de le jeter dans le drain ou les égouts.
Suivre avec : Acide acétique







