Nous expliquons ce que sont les alcanes, les utilisations et les propriétés de ces hydrocarbures et leurs caractéristiques générales.

Que sont les alcanes ?
Les alcanes constituent l’une des principales familles d’ hydrocarbures (composés organiques constitués d’atomes de carbone et d’hydrogène).
Les alcanes sont très importants comme combustibles domestiques et industriels, car ils sont utilisés pour le fonctionnement des chaudières, des turbogénérateurs et des cuisinières à gaz, entre autres. Ils sont également des intrants dans diverses industries telles que le verre , le textile et le plastique .
Voir aussi: Chimie organique
types d’alcanes
Les alcanes peuvent être des aliphatiques ou des cycloalcanes.
- Alcanes aliphatiques . Aussi appelées paraffines, elles ont une structure linéaire et obéissent à la formule générale C n H 2n+2 , où n représente le nombre ou la quantité d’atomes de carbone dans le composé (elles contiennent plus de deux fois plus d’ atomes d’ hydrogène que de carbone )
- Cycloalcanes . Ils ont une structure en forme de cycle et leur formule générale est C n H 2n .
Caractéristiques des alcanes

- Ils sont associés aux êtres vivants . Bien que les alcanes ne soient pas des matériaux essentiels pour les êtres vivants , ils apparaissent souvent comme des produits intermédiaires ou finaux du métabolisme microbien. C’est le cas, par exemple, de la fermentation méthanogène réalisée par des bactéries du rumen d’ animaux .
- Certains alcanes, comme le méthane (CH 4 ), peuvent être inflammables, explosifs ou toxiques , ils doivent donc être manipulés avec une extrême prudence.
- Ce sont des hydrocarbures saturés car les liaisons entre les atomes de carbone sont simples et stables. Cela les différencie des alcènes et des alcynes, qui se caractérisent par des liaisons doubles et triples, respectivement, entre leurs atomes de carbone . Par exemple:
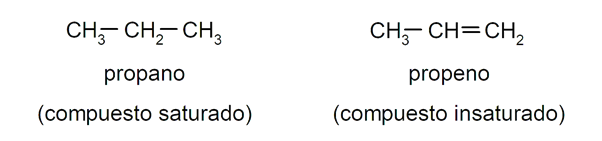
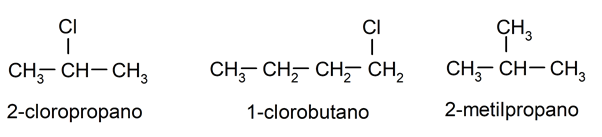
- Ils peuvent avoir des substituants . Les atomes d’hydrogène liés à chaque atome de carbone peuvent être remplacés par d’autres atomes, tels que des halogènes (fluor, brome, chlore) ou divers groupements ou « radicaux » (les groupements hydroxyle (OH – ) et méthyle (CH 3 -) sont très fréquents) ). Dans ce dernier cas, la structure devient plus complexe, donnant naissance à des alcanes ramifiés. Par exemple:
- Ils peuvent former des structures fermées . Les atomes de carbone sont liés les uns aux autres donnant lieu à la formation de chaînes, mais les extrémités de ces chaînes peuvent se combiner et former alors les alcanes dits cycliques, comme dans le cas du cyclohexane, du cyclopentane et du cyclobutane.

Propriétés physiques des alcanes

Les propriétés physiques des alcanes sont largement déterminées par le nombre d’atomes de carbone qu’ils contiennent dans leur structure . Ainsi, par exemple, les alcanes ayant entre 1 et 4 atomes de carbone sont des gaz à température ambiante ; ceux avec 5 à 17 atomes de carbone sont liquides à cette même température, et ceux avec 18 atomes de carbone ou plus sont solides à température ambiante.
- Mauvaise solubilité . En général, les alcanes sont peu ou pas solubles dans l’eau , et à mesure que le poids moléculaire augmente, la solubilité devient encore moindre. Dans les solvants organiques, cependant, la solubilité est élevée.
- Faible densité . Leur densité est inférieure à celle de l’eau, c’est pourquoi ils ont tendance à flotter. Cela se voit très bien lorsque des déversements d’hydrocarbures se produisent en mer , comme les marées noires (mélange de nombreux hydrocarbures). D’autre part, la densité des alcanes augmente à mesure que leur masse moléculaire, c’est-à-dire le nombre d’atomes de carbone, augmente.
- Point de fusion et d’ébullition variables . Les points de fusion et d’ébullition dépendent du nombre d’atomes de carbone (plus le nombre est élevé, plus le point de fusion et d’ébullition est élevé), mais aussi de la structure : les structures linéaires ont un point de fusion et d’ébullition plus élevé que les ramifiées. Le point d’ébullition des alcanes augmente d’environ 30°C chaque fois qu’un atome de carbone est ajouté au composé.
- conductivité électrique . Habituellement, les alcanes ne conduisent pas l’électricité .
Réactions chimiques des alcanes
Les réactions les plus courantes que les alcanes peuvent subir sont :
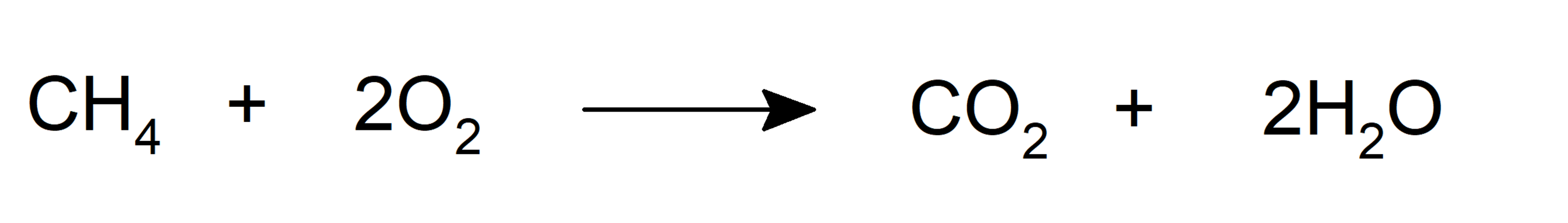
- oxydation . Lorsqu’ils sont combinés avec de l’oxygène, ils peuvent former du dioxyde de carbone et de l’eau et libérer de l’énergie sous forme de chaleur. C’est la réaction typique de combustion.
- Halogénation . Le chlore et le brome, le fluor et l’iode peuvent remplacer les atomes d’hydrogène dans l’alcane. Les produits de réaction sont constitués de différentes proportions de différents alcanes halogénés. Un exemple est le chloroforme, qui est un hydrocarbure halogéné (trichlorométhane).
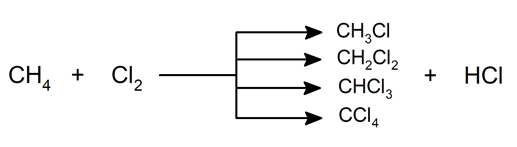
- Nitratation . A haute température et en présence de vapeurs d’acide nitrique, la substitution d’un hydrogène par le groupe NO 2 – peut se produire , ce qui génère des nitroalcanes dans des proportions différentes.
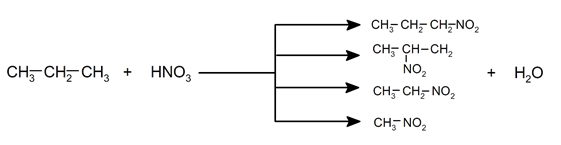
- Isomérisation . C’est la restructuration de la molécule sans perte ni gain d’atomes. Habituellement, cette réaction nécessite l’utilisation de catalyseurs. Par exemple:
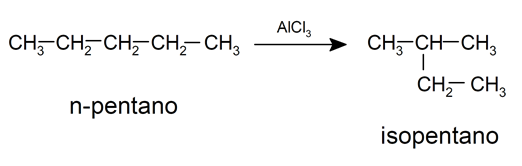
- pyrolyse . C’est la décomposition des alcanes par exposition à des températures très élevées et sans présence d’ air , de cette manière leur combustion est évitée et la décomposition des molécules est prioritaire, rompant leurs liaisons chimiques . Cette réaction est utilisée dans l’industrie pour fabriquer des alcènes et des alcanes à chaîne courte à partir d’alcanes à chaîne plus longue.
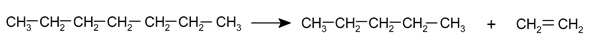
Il peut vous servir : Composés organiques