Nous expliquons ce que sont les alcènes et les propriétés physiques et chimiques qu’ils présentent. Aussi, quelles sont ses caractéristiques et exemples.
Que sont les alcènes ?
Les alcènes sont connus comme un type d’hydrocarbures insaturés (qui ont perdu des hydrogènes attachés aux atomes de carbone adjacents ) dans les molécules desquels il est possible de trouver des doubles liaisons carbone-carbone.
À leur tour, les hydrocarbures aliphatiques peuvent être classés comme linéaires, monocycliques (un seul cycle composé d’atomes de carbone) et polycycliques (avec plusieurs cycles liés), de sorte qu’il peut y avoir des alcènes appartenant à toutes les classifications.
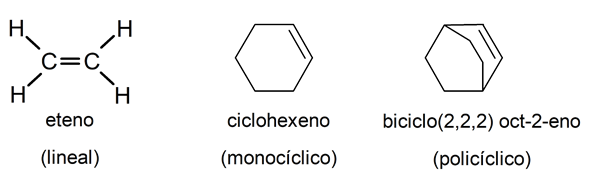
Voir aussi: Métaux alcalins
Nomenclature des alcènes
Les alcènes étaient autrefois appelés « oléfines » parce que leurs représentants les plus simples, tels que l’éthène, réagissaient avec des halogènes pour produire des huiles.
Selon la nomenclature systématique, ces composés sont nommés en utilisant la même règle que pour les alcanes. Trouvez la plus longue chaîne carbonée contenant la double liaison. En cas d’avoir plus d’une double liaison, la chaîne qui a la plus petite combinaison des positions de ces doubles liaisons est trouvée. Si la molécule a des substituants, on les nomme en mettant le préfixe numérique qui correspond à la position du carbone auquel ils sont liés (1,2,3…), mais si elle a plusieurs substituants identiques, le préfixe est mettre aussi (di, tri, tétra..) selon qu’il y en a deux, trois ou quatre.
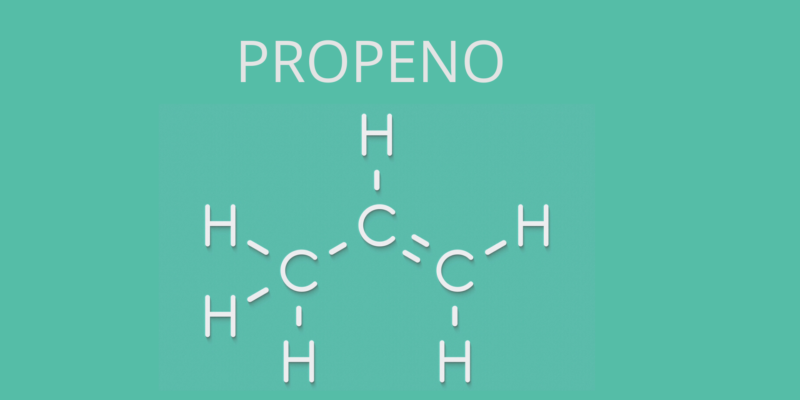
Cependant, de nombreux alcènes sont connus par leur nom non systématique (comme c’est souvent le cas avec les hydrocarbures) et dans ce cas la terminaison officielle (–ène) est remplacée par –ylène, comme c’est le cas avec l’éthène, également appelé éthylène, ou avec du propène, appelé propylène.
D’autre part, s’il y a plus d’une double liaison, les terminaisons –diene (deux doubles liaisons) ou –triene (trois doubles liaisons), etc. sont utilisées respectivement.
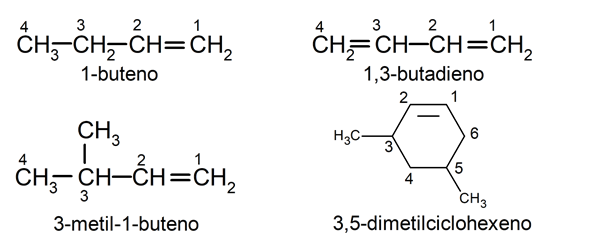
Formule générale des alcènes
La formule générale des alcènes linéaires est C n H 2n , où n représente le nombre d’atomes de carbone respectifs . Cela signifie que pour chaque nouvelle double liaison, il y aura deux atomes d’hydrogène de moins que ce qui est indiqué dans cette formule.
Différence avec les alcanes et les alcynes

Les alcènes diffèrent des alcanes et des alcynes par la double liaison qui apparaît entre leurs atomes de carbone . On dit souvent, en effet, qu’un alcène est un alcane qui a perdu des atomes d’hydrogène, libérant ainsi deux électrons qui constituent la deuxième liaison de chaque double liaison.
Les alcanes ont une liaison simple entre leurs carbones (CC) ; les alcènes au moins une double liaison (C=C) et les alcynes au moins une triple liaison (C≡C).
Propriétés physiques des alcènes
Les alcènes ont les propriétés physiques suivantes :
- Selon leur nombre d’atomes de carbone, les alcènes peuvent être des gaz (moins d’atomes) ou des liquides (plus d’atomes).
- Ils sont insolubles dans l’eau mais solubles dans l’éther, le chloroforme ou le benzène.
- Ils sont moins denses que l’eau.
- Ils ont une polarité moléculaire partielle ou nulle en fonction de la géométrie de chaque molécule autour de la double liaison.
- Ils ont une acidité plus élevée que les alcanes correspondants, un produit de la polarité de la liaison.
- Son point d’ébullition et de fusion ne varie pas beaucoup par rapport aux alcanes correspondants.
Propriétés chimiques des alcènes

Les alcènes se caractérisent par une forte réactivité chimique vis-à-vis des alcanes et leurs réactions majoritaires sont l’addition. Les réactions les plus fréquentes sont :
- Ajout d’halogénures d’hydrogène . Réaction avec HCl ou HBr.
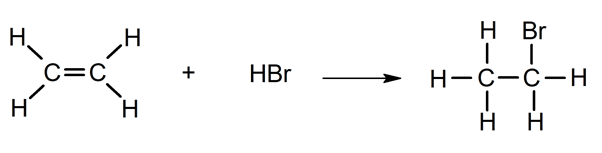
- Halogénation . Réaction avec les halogènes (Cl 2 , Br 2 ).
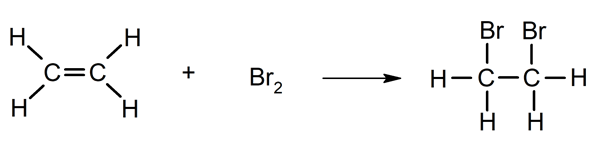
- polymérisation . Vital dans l’ industrie pétrolière et ses dérivés, puisque des chaînes longues et résistantes de matière malléable ( plastiques ) sont réalisées.

Abondance d’alcènes
Les alcènes sont beaucoup moins abondants que les alcanes , en fait ils se trouvent dans l’huile naturelle mais en tant que composant très mineur.
Les procédés de craquage du pétrole, d’autre part, sont une source importante d’alcènes utilisables pour l’industrie. Cependant, les alcènes sont courants en chimie organique et font partie des réactions courantes chez les êtres vivants , en particulier les plantes et les végétaux.
synthèse d’alcène
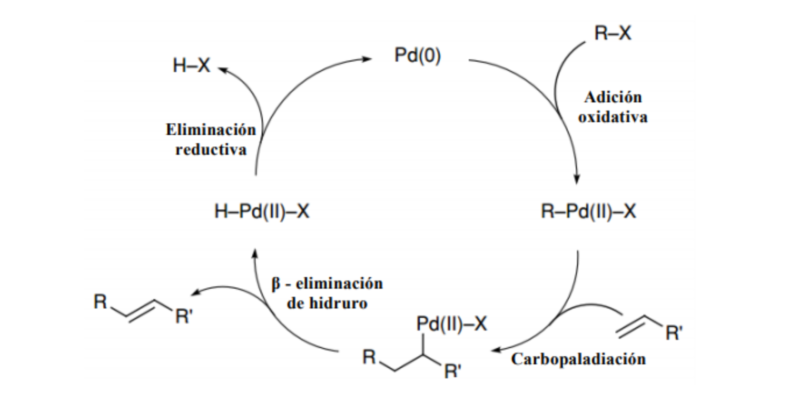
Les réactions qui produisent des alcènes en conséquence et qui peuvent donc être utilisées pour les synthétiser sont :
Déshydrohalogénation .
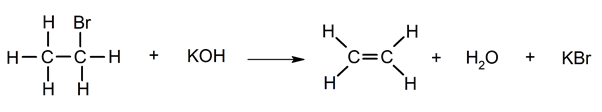
déshalogénation _
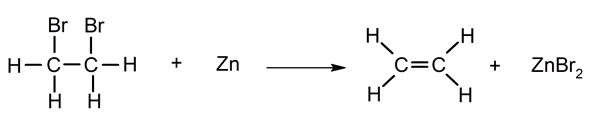
Élimination de l’eau des alcools .
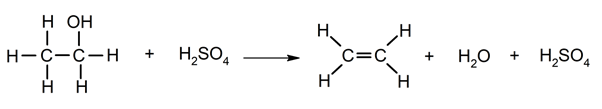
pyrolyse .
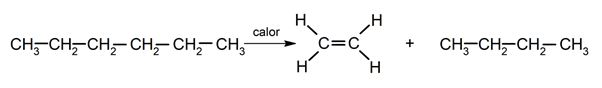
Ils peuvent également être obtenus à la suite de la réaction de Chungaev et de la réaction de Grieco, par formation de liaisons carbone-carbone (Wittig Reaction, Julia Olefination, etc.), par des réactions péricycliques ou des réactions de couplage avec des métaux (Suzuki Reaction, Heck’s reaction) .
diènes et polyènes
S’il y a plus d’une double liaison dans la molécule, on sera en présence d’un diène (deux liaisons), d’un triène (trois liaisons) ou d’un polyène (multiples liaisons).
Ces composés manquent cependant de propriétés particulières et se comportent comme des alcènes normaux , sauf qu’ils présentent des réactivités très particulières, selon la localisation dans la molécule des doubles liaisons multiples.
Stabilité des alcènes
Les alcènes sont plus ou moins stables, selon l’endroit où se trouve la double liaison dans la molécule . Les alcènes internes, dont la double liaison est située vers le centre de la molécule, sont beaucoup plus stables que ceux dont la double liaison est située aux extrémités. De cette façon, les isomères trans sont plus stables que les cis .
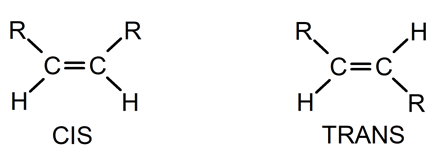
Exemples d’alcènes
Certains alcènes communs sont:
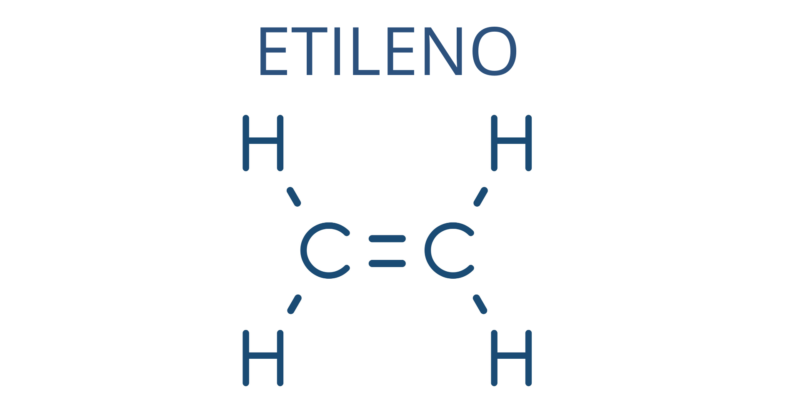
- Éthène (CH 2 =CH 2 )
- Propène (CH 2 =CH-CH 3 )
- 1-butène (CH 2 =CH-CH 2 -CH 3 )
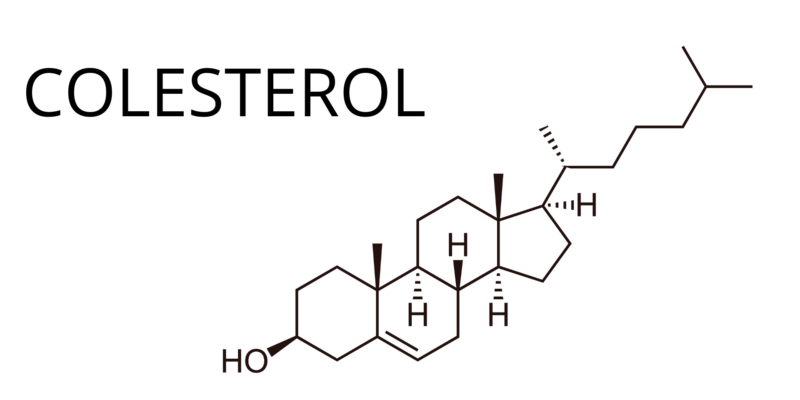
- Cholestérol (C 27 H 46 O 6 )
- Lanostérol ( C30H50O ) _
- Camphre (C 10 H 16 O)
- Myrcène (C 10 H 16 )
Il peut vous servir : Polymères