Nous expliquons ce qu’est le carbone, pourquoi cet élément est si important pour la vie et quelles sont ses principales caractéristiques.

Qu’est-ce que l’atome de carbone ?
Le carbone est l’un des éléments les plus abondants sur Terre , essentiel à la vie . C’est le principal composant de la matière organique; il intègre également le produit final du métabolisme de la plupart des êtres vivants et du processus de combustion car il fait partie du dioxyde de carbone (CO 2 ).
Le carbone se présente sous de nombreuses structures et également de manière amorphe ; leurs propriétés physiques sont souvent très contrastées. Il a la propriété de pouvoir se combiner avec presque tous les éléments ; il peut être associé aussi bien à des métaux qu’à des non-métaux (exemples : carbure de calcium (CaC 2 ), disulfure de carbone (CS 2 ), chloroforme (CHCl 3 ), etc.).
Environ 10 millions de composés carbonés sont estimés , dont beaucoup sont essentiels à la vie sur la planète.
Voir aussi: Chimie organique
Caractéristiques de l’atome de carbone

- Son numéro atomique est 6 et sa masse atomique est 12 . Cela signifie qu’il a 6 protons et 6 neutrons dans son noyau dans sa configuration stable, et que le noyau est entouré de 6 électrons. Ces électrons sont distribués selon la configuration électronique suivante : deux dans son premier niveau d’énergie (qui a une orbitale s) et quatre dans son deuxième niveau d’énergie (qui a des orbitales s et p), ceci est représenté par 1s 2 2s 2 2p 2 .
- C’est tetravelent . Cela signifie qu’il a 4 électrons en orbite dans son dernier niveau d’énergie, qui peuvent se combiner avec les électrons les plus externes d’autres atomes , souvent aussi du carbone, formant des liaisons covalentes . Cela signifie que le carbone peut former quatre liaisons chimiques .
- Il a une allotropie . Il peut se présenter sous différentes structures moléculaires, dans le même état physique, selon les conditions de formation. Les allotropes de carbone les plus importants sont : le diamant, le graphite, la lonsdaleite, le fullerène, le nanotube de carbone, le carbone amorphe et le graphène.
- Il contient des isotopes . Le carbone ne possède que deux isotopes naturels : le carbone 12, qui est majoritaire (98,90 %), et le carbone 13, présent en proportion minime (1,10 %). De plus, il existe treize isotopes instables dont la demi-vie ou demi-vie varie de 200 nanosecondes (comme dans le carbone 22) à 5730 ans (comme dans le carbone 14). Le carbone 13 est utilisé dans les études structurales (notamment RMN/Résonance Magnétique Nucléaire), le carbone 14 est utilisé pour dater les objets archéologiques, compte tenu de sa très longue demi-vie.
- Il se combine facilement . Le carbone peut être combiné avec des métaux et des non-métaux (par exemple : carbure de calcium (CaC 2 ), disulfure de carbone (CS 2 ), chloroforme (CHCl 3 ), etc.). On estime qu’il existe environ 10 millions de composés carbonés, dont beaucoup sont essentiels à la vie.
hybridations carbone
Les orbitales atomiques sont les probabilités de trouver un électron dans une région de l’espace autour du noyau atomique. L’hybridation est l’interaction entre ces orbitales qui, lorsqu’elles sont superposées, forment des orbitales hybrides qui conduisent à la formation de différentes liaisons chimiques.
Dans le cas du carbone, ses quatre électrons de coquille les plus externes peuvent se combiner avec les électrons d’autres atomes, ainsi, l’atome de carbone peut former trois types d’hybridations , qui ont des implications sur la géométrie moléculaire finale des composés qu’il forme avec le carbone. Ces hybridations peuvent être :
- hybridation sp 3 . Expliquez la formation et la géométrie des composés à liaisons simples, qui ont une géométrie en forme de tétraèdre.
- hybridation sp 2 . Expliquer la formation et la géométrie des composés à doubles liaisons, qui peuvent avoir une géométrie trigonale plane.
- hybridation sp . Expliquez la formation et la géométrie des composés à triples liaisons, qui ont une géométrie linéaire.
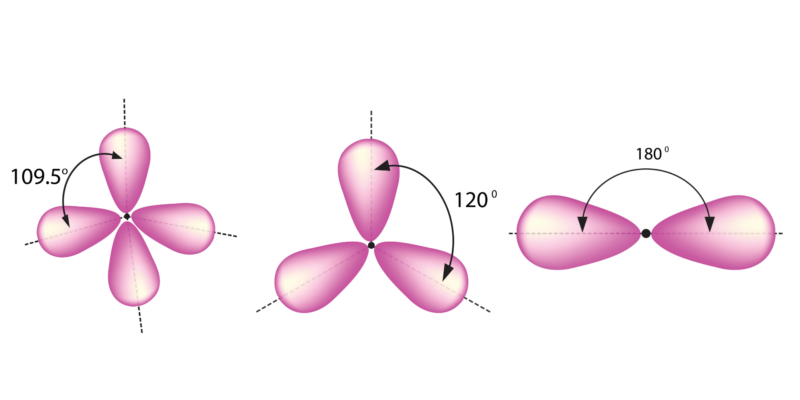
Géométrie moléculaire selon le type d’hybridation. De gauche à droite : sp 3 , sp 2 et sp.
Trois configurations possibles
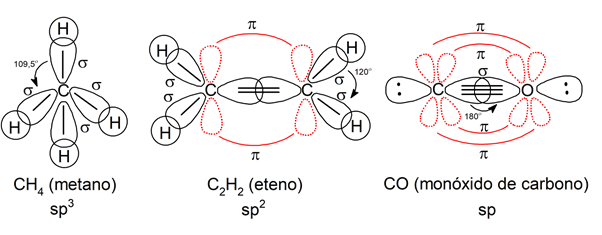
Puisque le type de liaison (déterminé par le type d’hybridation) détermine l’angle de liaison, il existe à son tour trois géométries moléculaires possibles lorsque le carbone participe à la formation d’une liaison chimique :
- La liaison simple détermine la formation d’un tétraèdre, avec des angles de 109,5°.
- La double liaison détermine la formation d’une structure triangulaire plate, avec des angles de 120°.
- La triple liaison détermine la formation d’une structure linéaire, avec des angles de 180°.
réactivité du carbone
- Les composés à base de carbone qui ont des liaisons multiples (doubles ou triples) entre les atomes de carbone sont plus réactifs que ceux à liaisons simples.
- Le carbone réagit avec l’hydrogène pour former des hydrocarbures .
- C’est du carburant.
- Le carbone réagit avec l’oxygène pour former principalement du dioxyde de carbone (CO 2 ) et du monoxyde de carbone (CO).
Ressemblance relative avec le silicium
Le carbone est le premier membre du groupe IVA dans le tableau périodique des éléments. Vient ensuite dans ce même groupe le silicium (Si), qui possède également 4 électrons dans sa couche la plus externe, mais à un niveau d’énergie plus élevé.
Cependant, le silicium ne peut pas former de liaisons multiples silicium-silicium en raison de la répulsion qui génère un plus grand nombre d’électrons internes, ce qui signifie que les atomes ne peuvent pas se rapprocher suffisamment. D’autre part, les deux éléments sont des non-métaux et sont solides à température ambiante .
Kekulé et les bases de la chimie organique
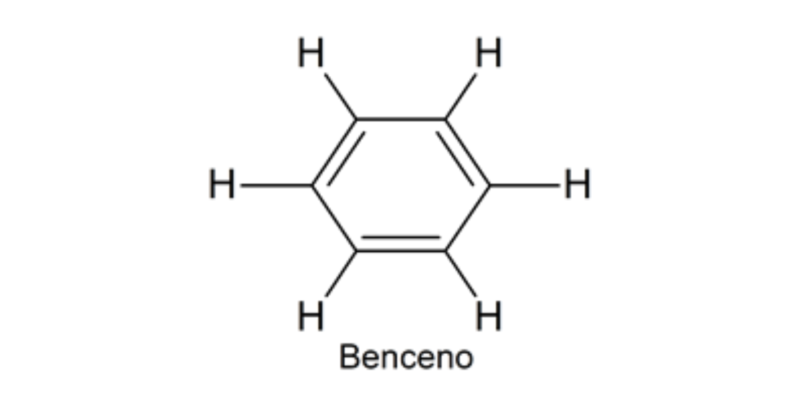
Le chimiste allemand August Kekulé a postulé en 1858 une théorie structurale qui permettait d’expliquer le phénomène de résonance du benzène. Il a proposé que le benzène soit composé de 6 atomes de carbone et de 6 atomes d’hydrogène , mais les atomes de carbone sont disposés sous la forme d’un cycle et les liaisons entre eux alternent entre simples et doubles. C’était fondamental en tant qu’antécédent au concept de liaison covalente introduit par Lewis, qui sert de base à la compréhension de la chimie du carbone en général.
Continuer avec : Alcènes







