Nous expliquons ce qu’est l’azote, ses propriétés atomiques et ses utilisations. Aussi, quelles sont ses caractéristiques et ses effets sur la santé.

Qu’est-ce que l’azote ?
L’azote est un élément chimique qui, dans le tableau périodique, est représenté par la lettre « N » . Dans des conditions normales de pression et de température , il se présente à l’état gazeux et est appelé gaz diatomique ou moléculaire (N 2 ). Il a une électronégativité de 3 sur l’échelle de Pauling et son numéro atomique est de 7.
Propriétés physiques de l’azote
L’azote est un gaz inodore, incolore et insipide qui constitue 78 % de l’air que nous respirons. C’est un non- métal qui se trouve à l’état gazeux à pression et température normales. Son point de fusion est de -210 ºC et son point d’ébullition est de -195,79 ºC. En revanche, il a une densité de 1,25046 kg/m 3 et n’est pas un bon conducteur d’ électricité ou de chaleur.
isotopes de l’azote
Les isotopes stables de l’azote sont 14 N et 15 N , et le premier est beaucoup plus abondant que le second. De plus, d’autres isotopes d’origine radioactive peuvent être trouvés, tels que 12 N, 13 N, 16 N et 17 N.
Propriétés atomiques de l’azote

- Masse atomique : 14,0067 amu (unité de masse atomique)
- Numéro atomique : 7
- Symbole : N
- Rayon atomique : 56 pm (picomètres)
- États d’oxydation : -3, +1, +2, +3, +4, +5
États d’agrégation de l’azote
Dans la nature, l’azote se trouve à l’état gazeux . Cependant, l’homme a pu transformer cet état en liquide et en solide par des variations de température et de pression.
Bien que ses utilisations les plus notables soient à l’état liquide , il est important de noter que l’azote liquide ne doit être utilisé qu’à des fins spécifiques et avec les précautions appropriées à l’esprit.
Comme sa température est très basse à l’état liquide, il peut endommager la peau et générer des brûlures par le froid.
Obtention d’azote

Ce non-métal peut être obtenu par la mise en oeuvre de divers procédés. Parmi les plus utilisées figurent la distillation fractionnée et la liquéfaction de l’air , puisque l’azote occupe 78 % de l’air.
abondance d’azote

En plus d’être présent dans l’air que nous respirons comme élément majeur, on retrouve l’azote dans les aliments, les plantes , les engrais, les substances vénéneuses, et même dans les explosifs . De plus, l’isotope azote-14 se trouve dans les étoiles , où il se forme par fusion nucléaire.
Structure de l’azote
L’azote est composé de deux types d’isotopes : N14 et N15 . De plus, d’autres types d’isotopes d’origine radioactive peuvent être trouvés tels que N12, N13, N16 et N17, donc à l’état liquide ou solide, il doit être manipulé avec un soin particulier.
Fonction de l’azote dans la nature
L’azote apporte une contribution importante à l’ environnement : sans cet élément, la vie sur terre ne serait pas possible . Cet élément fait partie des protéines et des acides nucléiques (ADN et ARN), ce qui signifie qu’il fait partie de la base de la vie.
Bien qu’il y ait une grande quantité d’azote à l’état gazeux (N 2 ) dans l’ atmosphère terrestre , il est très difficile pour les plantes de l’incorporer de cette manière, elles l’assimilent donc sous forme d’ions ammonium (NH 4 + ) ou nitrates (NO 3 – ). Pour cette raison, certaines bactéries transforment l’azote en ces formes que les plantes peuvent absorber, de sorte que les animaux peuvent ensuite ingérer les plantes et, par ce processus, incorporer l’azote.
En d’autres termes, sans la présence d’azote, les bactéries ne pourraient pas transformer le sol en une base fertile pour les plantes . Pour cette raison on considère que l’azote intervient dans le cycle de vie des écosystèmes .
utilités d’azote

Parmi les fonctions de l’azote, on retrouve les suivantes :
- Comme conservateur pour les aliments emballés, car il arrête son oxydation.
- Les ampoules contiennent de l’azote, qui se trouve être plus accessible que lorsque l’argon était utilisé.
- Il est utilisé dans les explosifs liquides pour les empêcher d’exploser.
- Il est utilisé pour la fabrication de pièces électroniques telles que des transistors ou des circuits intégrés.
- Il est utilisé dans les carburéacteurs car il aide à prévenir les risques d’incendie.
- L’azote liquide aide à préserver le sang et les plaquettes.
- Il est présent dans presque tous les médicaments pharmacologiques consommés (le protoxyde d’azote est utilisé comme anesthésie).
- Il est utilisé pour fabriquer de l’ acier inoxydable.
- Il est utilisé pour produire des engrais.
Effets de l’azote dans l’organisme
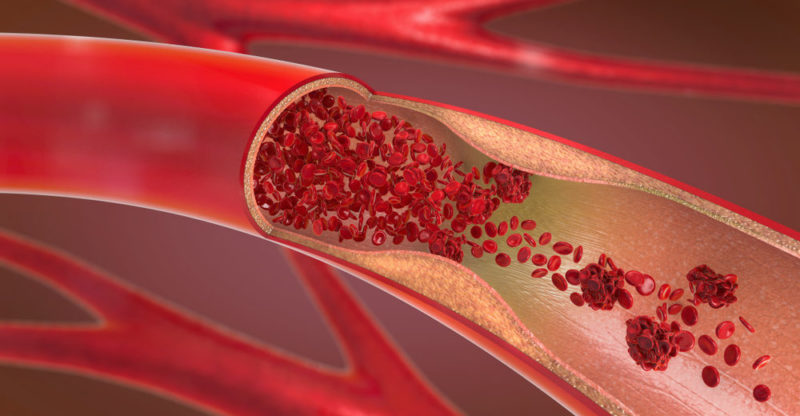
L’azote à l’état naturel se trouve dans l’air sous forme d’azote moléculaire (N 2 ); dans le sol et l’eau , on le trouve formant des composés tels que les nitrates (NO 3 – ) et les nitrites (NO 2 – ).
Cet azote composé ne s’avère pas si bénéfique pour la santé. Certains de ses principaux effets sont les suivants :
- Diminue le transport de l’oxygène dans le sang.
- Ralentit le fonctionnement de la glande thyroïde.
- Il ne permet pas la fixation correcte de la vitamine A dans l’organisme.
- Il favorise la production d’une substance appelée nitrosamine , responsable de la mutation cellulaire (cancer).
Curiosité : l’azote aux couleurs du ciel

Cet élément, avec l’oxygène, est responsable des couleurs bleu, vert, violet, orange et rouge qui apparaissent dans le ciel. Non seulement dans l’arc-en-ciel, mais aussi dans un coucher de soleil .
Il peut vous servir : Carbone