Nous expliquons ce qu’est le carbone et quelles sont ses principales caractéristiques. En outre, ses applications et quel est le cycle du carbone.

Qu’est-ce que le carbone ?
Le carbone est l’un des éléments les plus importants du tableau périodique , du moins en termes d’abondance et de nécessité pour la vie organique . Plus de 16 millions de substances contenant du carbone sont connues, dont de nombreux composés essentiels aux êtres vivants . Cet élément forme 0,2% de la croûte terrestre.
Le carbone existe sous de nombreuses formes , selon les conditions environnementales dans lesquelles il se trouve, et constitue l’un des éléments les plus utilisés par l’homme et les plus présents dans la société . En fait, notre corps exhale du dioxyde de carbone (CO 2 ) en tant que produit de la respiration, et on le retrouve sous forme de monoxyde de carbone (CO) dans les gaz d’échappement des moteurs à combustion.
Voir aussi : Fer
caractéristiques du carbone
- Le carbone dans le tableau périodique fait partie des carbonoïdes, avec le numéro atomique 6, la masse atomique 12,01 et est représenté par le symbole C.
- C’est un élément non métallique et c’est un bon conducteur d’ électricité lorsqu’il est sous forme de graphite.
- D’une manière générale, le carbone n’est pas une substance hautement toxique. Dans la plupart de ses formes physiques, il est sans danger pour la manipulation humaine. Cependant, de nombreux composés organiques et inorganiques à base de carbone peuvent être toxiques et même mortels pour les humains . Les hydrocarbures, par exemple, peuvent avoir un effet dévastateur sur le système respiratoire , ainsi que le charbon (il existe de nombreux cas de détérioration de la santé chez les travailleurs des mines de charbon et les travailleurs des stations d’exploitation d’ hydrocarbures ).
- Le dioxyde de carbone et le monoxyde de carbone (CO 2 et CO) sont des substances mortelles s’ils sont inhalés à fortes doses, car ils empêchent une bonne oxygénation du corps. L’isotope du carbone 14, étant radioactif, représente un risque de contamination dans une certaine mesure. Le cyanure (CN – ), l’un des poisons les plus meurtriers et les plus répandus, est composé d’atomes de carbone et d’azote .
- Il est possible de trouver des traces de carbone et d’hydrocarbures sur des planètes lointaines, telles que les géantes gazeuses du système solaire , sans que cela n’indique un quelconque type de constitution de vie organique, à notre connaissance.
Formes de carbone (halotropes)

Bien que le carbone soit solide à température ambiante , lorsqu’il forme du graphite il peut se sublimer lorsque la température dépasse 3600°C et devenir gazeux . Dans la nature, cependant, il se présente sous six formes différentes ou allotropes (propriété de présenter des structures moléculaires ou atomiques différentes) :
- Carbone amorphe . Comme la suie ou la plupart des charbons, l’élément pur apparaît sans structure déterminée.
- graphite . Noir, opaque et doux, le graphite a la propriété de tacher, c’est pourquoi il est utilisé comme charge pour les crayons de bois .
- Diamant . Le diamant et le graphite contiennent les mêmes atomes de carbone mais dans une structure différente, ils ont donc également des propriétés différentes. Le diamant est une pierre précieuse transparente et extrêmement dure.
- fullerènes . Découvert au milieu des années 80, il s’agit d’environ 60 atomes de carbone structurés non plus en hexagonal, comme d’habitude, mais en heptagonal ou pentagonal. Cela lui donne un aspect sphérique, comme un ballon de football.
- Nanotubes . L’un des premiers produits de l’industrie des nanotechnologies, ce n’est rien d’autre que des feuilles de graphite laminées cylindriquement et surmontées à leurs extrémités d’hémisphères de carbone.
- carabines . L’un des produits industriels les plus puissants des dernières décennies, il est constitué d’un atome de carbone rendu univalent et électriquement neutre, qui est la substance la plus résistante jamais connue.
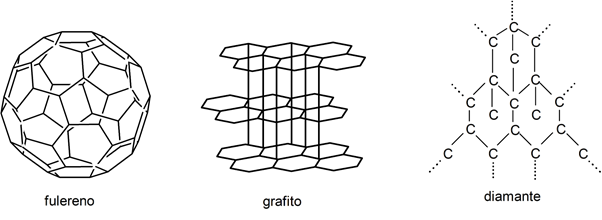
composés chimiques avec du carbone

Composés organiques à base de carbone
De nombreuses substances essentielles à la vie ont du carbone comme base. Les acides gras (fabriqués à partir de combinaisons de carbone, d’oxygène et d’hydrogène ), les esters présents dans les fruits, la plupart des acides aminés, les enzymes et les protéines qui maintiennent la vie , le benzène, les glucides qui nous donnent de l’énergie, le tout à partir de combinaisons de carbone.
La chimie du carbone est connue sous le nom de chimie du vivant , puisque les êtres vivants connus à ce jour reposent sur des structures moléculaires à base de carbone. Le CO 2 est essentiel pour la photosynthèse, par exemple.
Composés inorganiques à base de carbone
Dans sa capacité de combinaison extrêmement élevée, le carbone se trouve également dans de nombreuses substances inorganiques. Les carbonates (calcites (CaCO 3 )), de nombreux sels et acides (acide carbonique (H 2 CO 3 )) , ou des formes métalliques comme les carbures et les acétylures (carbure de calcium (CaC 2 )), tous deux très acides, sont des composés inorganiques de carbone.
Il peut vous aider : Chimie organique
hydrocarbures

Les hydrocarbures sont des substances composées d’atomes d’hydrogène et de carbone . Ces substances sont liées à la vie (notamment en tant que combustibles fossiles), bien qu’elles puissent exister sur des planètes qui ne l’ont jamais hébergée. Le pétrole et ses dérivés, les gaz naturels, le méthane, sont des hydrocarbures aux performances industrielles très élevées compte tenu de leur caractère inflammable .
Plus dans: Hydrocarbures
extraction de carbone

Puisque le carbone est si abondant sur notre planète , il a tendance à abonder dans les régions souterraines où la pression et la température lui permettent de se réorganiser dans diverses structures. Ainsi, il y a des mines de charbon, mais aussi des mines de graphite et de diamants.
La Chine , les États-Unis et l’ Union européenne sont les trois plus grands exploitants de charbon de la planète, bien qu’il soit abondamment distribué dans les 100 pays qui l’extraient . Au lieu de cela, les hydrocarbures fossiles beaucoup plus convoités se trouvent dans de grands gisements au Moyen-Orient , en Russie, en Alaska, au Mexique et au Venezuela , principalement.
L’extraction de diamants est concentrée principalement en Afrique du Sud et en Amérique du Sud , bien qu’il existe d’autres mines à plus petite échelle en Amérique du Nord et en Asie du Sud. L’exploitation africaine a été très controversée en raison de son coût humain et politique sur la population locale .
Applications industrielles du carbone

L’extraction du carbone sous ses diverses formes est une activité courante dans l’ économie humaine , qui mobilise de véritables masses autour de son extraction du sous-sol (charbon, graphite et hydrocarbures) et de son raffinage et utilisation ultérieurs.
Les hydrocarbures, surtout, sont un élément indispensable de la machinerie industrielle moderne, car ce sont des carburants performants pour tous les types de transport, grâce au fait que le pétrole permet une large gamme de dérivés utilisables tels que le plastique ou le nylon. Il en va de même pour l’industrie des lubrifiants automobiles.
Le charbon, en revanche, est principalement utilisé comme combustible pour produire de l’électricité, même si ses effets polluants sont redoutés et avérés. Il est également utilisé comme matériau combustible à usage domestique.
Le graphite est essentiel pour l’industrie du crayon et pour les barres de protection des réacteurs atomiques. Les diamants, paradoxalement, sont valorisés comme objets de décoration ou dans la fabrication de scalpels et d’outils qui tirent parti de leur dureté.
Enfin, l’isotope radioactif Carbone 14 est utilisé dans de nombreuses investigations scientifiques et archéologiques, comme marqueur de l’âge des restes organiques.
Cycle du carbone

La rétroaction entre les organismes végétaux, animaux et décomposeurs est connue sous le nom de cycle du carbone . La respiration animale et la décomposition de certains champignons libèrent des quantités importantes de CO 2 dans l’ atmosphère .
Ce CO 2 est utilisé, avec l’eau et la lumière du soleil , par la photosynthèse des plantes , dont le produit immédiat est l’oxygène et de nouvelles matières organiques (fruits, feuilles, écorces, animaux morts) qui se décomposent ensuite. Et le cycle recommence, retenant la vie à son tour.
Continuer avec : Polymères







