Nous expliquons ce que sont les composés organiques, leur composition et leur classification. En outre, ses caractéristiques et exemples.

Que sont les composés organiques ?
Par composés organiques, on entend les substances composées de divers éléments , dont la structure principale est basée sur le carbone et l’hydrogène , bien qu’ils puissent également contenir d’autres éléments associés à la chimie de la vie (biochimie) et jouer un rôle fondamental en tant que constituants.
Les molécules et composés organiques se produisent spontanément dans la nature , bien qu’ils puissent également être synthétisés en laboratoire.
La distinction entre composés organiques et inorganiques est complexe et a fait l’objet de nombreuses controverses au sein de la communauté spécialisée. Même ainsi, un point apparent de nature organique est la prédominance d’atomes de carbone liés à d’autres atomes de carbone et à des hydrogènes.
Cependant, toutes les molécules contenant du carbone et de l’hydrogène ne sont pas en fait organiques . Cette différenciation réside plutôt dans sa proximité avec la biochimie, c’est-à-dire la chimie connue du vivant .
Les composés organiques peuvent contenir une grande variété d’éléments , mais le carbone (C) et l’hydrogène (H) prédominent , ainsi que l’oxygène (O), l’azote (N), le soufre (S), le phosphore (P), le bore (B) et les halogènes . La présence de ces éléments ne garantit pas qu’un composé est organique, mais il n’y a pas de composés organiques qui manquent de carbone et d’hydrogène.
Voir aussi: Chimie organique
Caractéristiques des composés organiques

Les propriétés physiques et chimiques les plus caractéristiques des composés organiques sont : la combustibilité, la covalence, l’isomérie, la solubilité et la polymérisation.
- combustibilité _ L’une des principales caractéristiques des composés organiques est leur capacité de combustion, c’est-à-dire leur caractère inflammable. Cette capacité, dérivée de sa forte présence de carbone, est utilisée par les êtres vivants pour obtenir de l’énergie biochimique (ATP). De plus, l’homme utilise les fossiles d’êtres vivants anciens, dans lesquels ce carburant potentiel est à son meilleur. C’est ainsi que le pétrole , le charbon ou le gaz naturel sont utilisés pour diverses tâches afin d’obtenir de l’énergie .
- Covalence . Les composés organiques sont de nature covalente, c’est-à-dire non ioniques (ils répondent mal à la conduction électrique et à la solubilité dans les solvants polaires). En effet, la plupart de leurs liaisons atomiques sont covalentes (elles partagent des électrons entre les atomes) et ne se lient pas par attraction électrostatique, comme le font les ions métalliques avec les ions non métalliques pour former des composés ioniques.
- solubilité . L’un des principes de la chimie stipule que les substances se dissolvent dans une substance similaire (de polarité similaire). Ainsi certains composés organiques sont solubles dans l’eau , les plus polaires, car l’eau est polaire. D’autre part, selon la similitude de leurs polarités, d’autres composés organiques peuvent être solubles dans des alcools, des éthers ou des solvants fabriqués avec des substances de nature similaire.
- polymérisation . Le processus de polymérisation est unique aux composés organiques et aboutit à une macromolécule de haut poids moléculaire (polymère). Elle est réalisée à l’aide de molécules plus petites appelées monomères, qui sont liées par certains procédés chimiques de synthèse pour former de longues chaînes. Le plastique , par exemple, est un polymère qui s’est révélé être un matériau organique souple et résistant , aux usages industriels incalculables. La polymérisation est un exemple des nombreuses applications des connaissances de la chimie organique.
- isomérie _ De nombreux composés organiques présentent une isomérie, c’est-à-dire la capacité d’avoir des formules identiques dans le nombre et le type d’éléments impliqués, mais organisés de manière différente, ce qui se traduit par un composé final totalement différent.
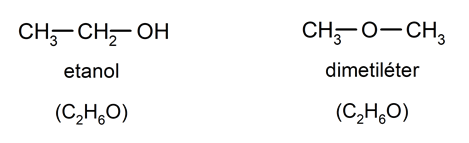
Origine des composés organiques

Les molécules organiques peuvent provenir de sources naturelles ou artificielles :
- naturel . Ils sont synthétisés par des êtres vivants, bien qu’ils puissent également être produits à la suite de processus naturels dans lesquels aucun être vivant n’est impliqué (comme les hydrocarbures du pétrole).
- artificiel . Ils sont fabriqués à partir de procédés artificiels en laboratoire, où des composés organiques qui n’existent même pas dans la nature sont obtenus.
Types de composés organiques
Il existe plusieurs types de composés organiques :
- Aliphatiques . Ils sont constitués d’atomes de carbone et d’hydrogène. Ils peuvent être linéaires, ramifiés ou cycliques, mais jamais aromatiques.
- aromatiques . Aussi appelé arènes, c’est la classe la plus nombreuse, initialement destinée aux dérivés du benzène et du goudron minéral. Ils se caractérisent par une plus grande stabilité moléculaire grâce à des liaisons simples et doubles (entre les atomes de carbone) qui alternent dans leur structure.
- Hétérocycliques . Ce sont des composés de nature cyclique (non linéaire) dont la structure comporte au moins un atome de carbone remplacé par un atome d’un autre élément.
- Organométallique . Ce sont des composés organiques qui sont liés à des atomes métalliques par des liaisons covalentes . Certains chimistes les considèrent comme un groupe distinct des organiques et des inorganiques.
- polymères . Ce sont des macromolécules organiques de masse moléculaire élevée, qui sont maintenues ensemble en formant de longues chaînes et donnent naissance à des substances plus complexes telles que des protéines ou de l’ADN.
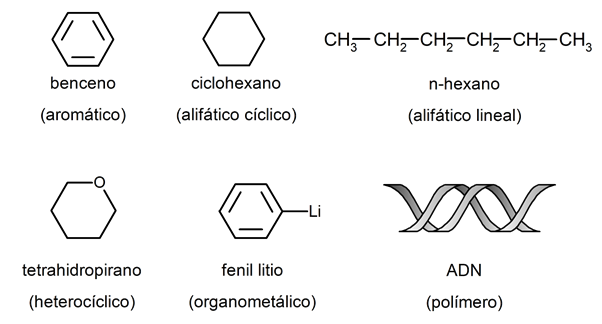
Exemples de composés organiques

Des exemples de composés organiques sont :
- protéines
- les glucides
- Hydrocarbures (gaz comme le méthane et le propane)
- Pétrole
- Acides nucléiques
- lipides
- Benzène
- savons
- colorants organiques
- Gaz naturel
- alcools
- Cétones
- esters
- Acides aminés
Continuer avec : Alcènes







