Nous expliquons ce qu’est l’état gazeux et les propriétés physiques et chimiques qu’il présente. En outre, ses caractéristiques et exemples.

Qu’est-ce que l’état gazeux ?
L’état gazeux est l’un des états d’agrégation de la matière , avec les états solide , liquide et plasmatique. La matière à l’ état gazeux est appelée « gaz ». Il se caractérise par le fait qu’il est composé de ses particules très lâchement attachées les unes aux autres.
Les particules de substances à l’état gazeux ont très peu de force d’attraction entre elles , elles se dilatent donc sur toute la longueur et la largeur du récipient dans lequel elles se trouvent et s’adaptent à sa forme. C’est parce qu’ils vibrent avec beaucoup plus d’énergie et de vitesse que dans les liquides ou les solides.
En raison de cette cohésion presque nulle (forces qui unissent les particules) que possèdent les particules de gaz, elles ont une énorme capacité à se comprimer. La compression est un procédé utilisé industriellement pour liquéfier les gaz, occupant ainsi un volume réduit et facilitant leur transport.
Voir aussi : Incendie
Origine du nom gaz
Le terme « gaz » a été inventé par le scientifique d’origine flamande Jan Baptista van Helmont au 17ème siècle.
Il vient du terme latin chaos (« chaos ») , puisque l’état observable des particules d’un gaz tend vers la dispersion et un désordre apparent.
Comparé aux solides et aux liquides, le gaz est l’ état le plus chaotique de la matière .
Différence entre le gaz et la vapeur
La vapeur est un gaz qui, lorsqu’il est suffisamment comprimé à température constante, devient liquide. Le gaz, en revanche, ne peut pas être transformé en liquide dans ces conditions.
Propriétés physiques des gaz

Les gaz ont les propriétés physiques suivantes :
- Ils n’ont pas de forme définie, ils prennent donc la forme du récipient dans lequel ils sont contenus.
- Ils n’ont pas de volume défini, ils ont donc tendance à remplir tout le volume de l’espace où ils se trouvent.
- Ils sont hautement compressibles, c’est-à-dire que compte tenu de l’énorme espace entre leurs particules, ils peuvent être contraints d’occuper un volume plus petit.
- Les gaz sont des fluides , tout comme les liquides, et peuvent se déplacer avec peu de friction d’un récipient à l’autre.
- Les particules de gaz sont si éloignées les unes des autres que leur poids total est moindre et qu’elles sont moins affectées par la gravité , de sorte qu’elles peuvent rester en suspension dans l’ atmosphère .
- Les gaz peuvent être plus ou moins denses que l’air (selon leur nature), c’est-à-dire qu’ils peuvent monter ou descendre une fois libérés dans l’atmosphère.
- Le goût, l’odeur et la couleur des gaz dépendent des éléments chimiques qui les composent.
- Les gaz diffusent rapidement dans le vide ou entre d’autres gaz.
Propriétés chimiques des gaz
Les atomes et les molécules d’un gaz sont éloignés les uns des autres et se déplacent à des niveaux d’énergie très élevés. Par conséquent, il leur est impossible de rester ensemble et rigides comme dans le cas des solides.
L’état d’agrégation de la matière ne modifie pas les propriétés chimiques des substances qui la composent. Ainsi, la nature chimique des gaz peut être très variable : certains peuvent être inertes, d’autres inflammables, corrosifs ou toxiques , selon la réactivité chimique de leurs éléments.
loi générale sur les gaz
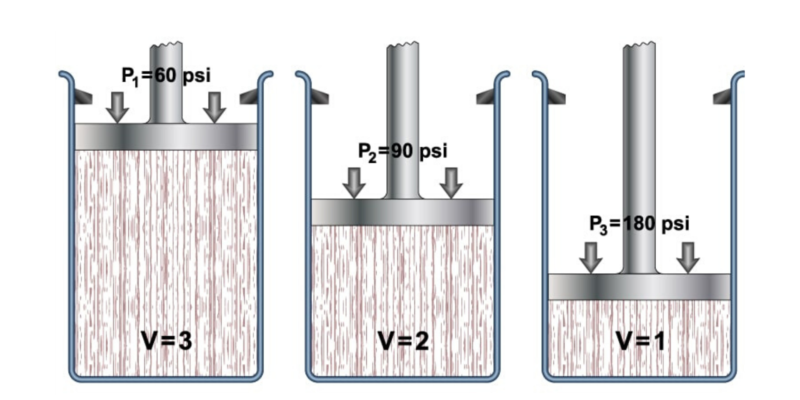
La loi générale des gaz décrit le comportement général des gaz , combinant un ensemble de lois plus spécifiques telles que la loi de Boyle-Mariotte, la loi de Charles et la loi de Gay-Lussac. Tous se réfèrent au comportement de la pression, du volume et de la température des gaz.
- Loi de Boyle-Mariotte . Aussi appelée loi de Boyle, formulée par Robert Boyle et Edme Marotte, elle relie la pression et le volume d’un gaz à sa température, de sorte que si la température est constante, les autres propriétés peuvent être déterminées. Cela s’exprime comme suit :
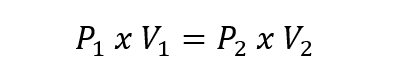
- Loi de Charles . Cette loi propose qu’à une pression donnée, le volume occupé par une quantité constante de gaz soit directement proportionnel à sa température exprimée en kelvins. Cela s’exprime ainsi :
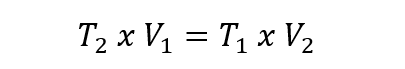
- Loi de Gay-Lussac . Cette loi exprime que pour une quantité de gaz certaine et constante, sa pression sera directement proportionnelle à sa température exprimée en kelvins, tant que le volume reste constant. Cela s’exprime ainsi :
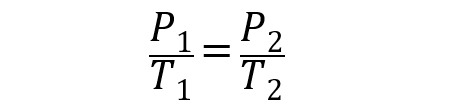
Dans toutes les équations ci-dessus, V 1 , P 1 et T 1 sont le volume initial, la pression et la température. Tandis que V 2 , P 2 et T 2 sont le volume final, la pression et la température.
La loi générale des gaz propose que, combinant les lois précédentes, il faut :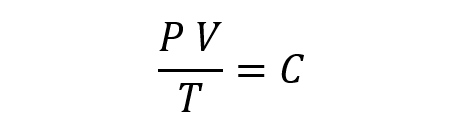
Ici, P est la pression, V est le volume, T est la température et C est une constante.
gaz parfaits
Les gaz idéaux sont appelés gaz hypothétiques ou théoriques qui sont un modèle de gaz créé par l’homme pour étudier et expliquer le comportement des gaz de manière plus simple. Pour étudier ce type de gaz, on peut utiliser l’équation d’état des gaz parfaits, qui est représentée par :
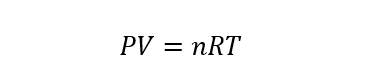
Où P est la pression, V est le volume, T est la température, n est le nombre de moles de gaz (qui doit rester constant) et R est la constante des gaz parfaits (égale à 8,314472 J/molK).
Les propriétés des gaz parfaits sont :
- Ils sont constitués d’un certain nombre de molécules .
- Il n’y a pas de forces attractives ou répulsives entre ses molécules.
- Il n’y a pas d’effondrement entre les molécules et aucun changement dans leur nature physique (c’est-à-dire des changements de phase).
- Un gaz parfait occupe toujours le même volume, dans les mêmes conditions de pression et de température .
More in: Gaz parfaits
gaz réels
Les vrais gaz sont ceux qui existent dans la vie réelle. Le comportement de ces gaz ne peut être étudié à l’aide de l’équation d’état des gaz parfaits, mais son étude nécessite l’utilisation d’équations plus complexes . Dans les gaz réels, contrairement aux gaz idéaux, les interactions entre leurs particules doivent être prises en compte. De plus, dans ces gaz, il peut y avoir des transitions de phase.
changements d’état dans les gaz

- évaporation _ Aussi appelé « vaporisation » est le processus par lequel un liquide devient un gaz. Ce processus se produit quotidiennement, lorsque l’énergie calorique des liquides augmente, par exemple sous l’action de la lumière solaire ou lorsqu’ils sont chauffés. L’évaporation se fait progressivement et il n’est pas nécessaire que tout le liquide soit chauffé jusqu’à son point d’ébullition (température à laquelle la pression de vapeur du liquide est égale à la pression entourant le liquide), il suffit qu’il soit chauffé pour s’évaporer petit à petit .
- bouillant _ C’est le processus par lequel, lorsque la température d’un liquide dépasse son point d’ébullition, il se transforme en gaz. Pour cela, il faut que toute la masse du liquide soit portée à une température égale ou supérieure au point d’ébullition.
- sublimation . C’est le processus de changement de phase qui conduit de l’état solide à l’état gazeux, sans passer par le liquide. Bien que dans certaines conditions de pression et de température, il puisse se produire avec de la glace, il se produit plus fréquemment avec d’autres substances, telles que l’iode, qui à 184 ºC passe directement de l’état solide à l’état gazeux.
- Sublimation inversée . Aussi appelé dépôt, ce changement de phase est contraire à la sublimation, c’est-à-dire qu’il implique le passage d’un gaz directement à un solide, sans passer au préalable par l’état liquide. Elle se déroule dans des conditions de pression très ponctuelles, qui forcent les particules de gaz à s’assembler pour former des structures moléculaires rigides. Un exemple courant de sublimation inverse se produit aux pôles de la Terre , au sommet des montagnes ou dans tout autre environnement où la température est si basse que l’eau liquide ne se forme pas à partir de l’humidité, mais plutôt de la glace et de la neige.
- condensation . C’est le processus opposé à l’évaporation, il s’agit de la soustraction de l’énergie thermique d’un gaz. En conséquence, ses particules se déplacent plus lentement et se rassemblent plus facilement, devenant des gouttelettes liquides sur les surfaces ou tombant au sol . C’est ce qui se passe dans la basse atmosphère lorsque, après s’être éloignée de la surface de la Terre , la vapeur d’eau évaporée se refroidit et forme des nuages, dont les gouttes d’eau retombent sur le sol : c’est la pluie . Cela peut également se produire lorsque l’humidité ambiante (état gazeux) entre en contact avec une surface froide, telle qu’une bouteille.
Exemples de composés à l’état gazeux

Voici quelques exemples de matière à l’état gazeux :
- Vapeur d’eau . Lors de l’évaporation, l’eau passe à l’état gazeux sous forme de vapeur : ce qui est parfaitement évident lorsque l’on fait bouillir de l’eau et qu’une colonne de vapeur blanchâtre s’élève de la marmite.
- air . L’air que nous respirons est une masse homogène de gaz, mélange d’éléments très différents tels que l’oxygène (O 2 ), l’hydrogène (H 2 ) et l’azote (N 2 ), généralement transparents, incolores et inodores.
- butane . C’est un gaz de nature organique et dérivé du pétrole , composé d’ hydrocarbures inflammables . Il est couramment utilisé comme combustible pour générer du feu dans nos cuisines, lorsque nous ouvrons la clé et que ce gaz se dégage.
- méthane . C’est un autre gaz d’hydrocarbure, un sous-produit fréquent des processus de décomposition de la matière organique. Il est possible de le trouver dans les marécages, les égouts ou même dans les intestins des animaux , où se trouvent des bactéries anaérobies qui le produisent. Il a une odeur désagréable très caractéristique.