Nous expliquons ce que sont les états solide, liquide et gazeux et les propriétés qu’ils possèdent. En outre, ses caractéristiques et exemples.
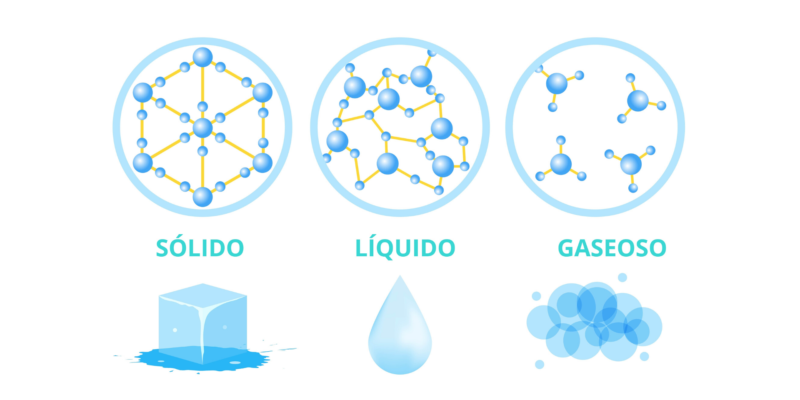
Quels sont les états solide, liquide et gazeux ?
Quand on parle d’ états d’agrégation de la matière , il s’agit de la manière dont la matière peut apparaître , selon la relation entre les particules qui la composent. Trois sont généralement connues, également appelées phases : l’état solide, liquide et gazeux.
L’état d’agrégation détermine les différentes propriétés physiques de la matière . Bien que les substances soient chimiquement identiques, les différences physiques sont drastiques. Cela se voit, par exemple, dans l’eau , qui peut être liquide, solide (glace) ou gazeuse. Bien que dans tous les cas la composition chimique de l’eau reste la même (H 2 O), physiquement elle se comporte différemment dans chaque état.
D’autres états d’agrégation moins fréquents existent également . Parmi eux se trouvent l’état plasmatique ou les supersolides, mais ces formes ne se produisent pas spontanément dans la nature, mais dans les laboratoires.
Voir aussi : Mélanges
état solide

La matière à l’état solide présente ses particules très unies par des forces attractives de grande intensité. Les particules sont très proches les unes des autres et vibrent lentement.
Ils se comportent comme un seul corps, avec une grande cohésion , une plus grande densité que les autres états, et une forme constante.
Les corps solides résistent à la fragmentation et sont dotés d’une mémoire de forme, c’est-à-dire qu’ils ont tendance à toujours rester identiques à eux-mêmes.
Les solides ont peu ou pas de fluidité , car ils conservent avant tout leur forme. En général, ils ne peuvent pas être compressés, car leurs particules sont aussi rapprochées que possible. Lorsqu’un solide est cassé ou fragmenté, de nouveaux objets solides plus petits sont obtenus.
Suivez : l’état solide
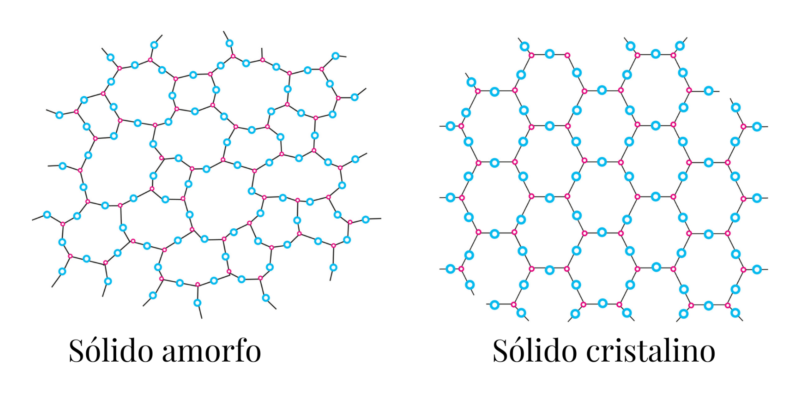
Types de solides et exemples

Il existe deux types de solides, selon la manière dont leurs particules sont ordonnées :
- Cristallin . Ils sont constitués de cellules disposées géométriquement, ils ont donc généralement une forme régulière et précise, basée sur un motif. Par exemple : les métaux , les composés ioniques tels que le chlorure de sodium (NaCl) et le diamant.
- Amorphe ou vitreux . Étant donné que ses particules ne se réunissent pas dans une structure ordonnée ou dans un certain motif, leur forme est généralement irrégulière et variée, selon les conditions dans lesquelles elles ont été produites. Par exemple : verre et caoutchouc.
l’état liquide

Dans le cas des liquides , leurs particules sont toujours maintenues ensemble par des forces attractives, mais elles sont beaucoup plus faibles et désordonnées que celles des solides . Pour cette raison, les liquides ne peuvent pas conserver une forme fixe ou stable, ni avoir autant de cohésion et de résistance que les solides.
Les liquides prennent la forme du récipient qui les contient, bien que leurs particules ne se dispersent pas nécessairement jusqu’à ce qu’elles occupent tout leur volume, comme cela se produit dans un gaz. D’autre part, ils ont une grande fluidité, en effet, ils peuvent être insérés et extraits à travers de petits espaces. Leur tension superficielle les fait coller aux objets, et c’est pourquoi l’eau se mouille.
Les liquides sont peu compressibles et ont leur propre volume . De plus, à l’exception de l’eau, ils ont tendance à rétrécir lorsqu’ils sont refroidis.
Types de liquides et exemples

Les liquides sont fluides, ils peuvent donc être classés selon leur fidélité aux principes physiques décrits par Isaac Newton dans ses études sur la viscosité. Ils peuvent être:
- Fluides newtoniens . Ils sont conformes aux dispositions de Newton, en maintenant leur viscosité constante. Ce sont les fluides les plus faciles à décrire, plus ils sont denses, plus ils s’écoulent lentement. Par exemple : eau, kérosène, essence et alcool.
- Fluides non newtoniens . Il s’agit d’un type particulier de fluide qui ne respecte pas les équations de Newton, puisque sa viscosité ou opposition à l’écoulement varie avec la variation de température , ils n’ont donc qu’une viscosité apparente. Ces fluides sont presque toujours obtenus artificiellement. Par exemple : poix, lave, sang et yaourt.
l’état gazeux

Les particules de gaz sont dans un tel état chaotique de dispersion et de distance qu’elles se maintiennent difficilement. La force d’attraction entre eux est très faible, de sorte que les gaz occupent un volume beaucoup plus important que les liquides et les solides.
Les substances à l’état gazeux ont tendance à se dilater jusqu’à occuper tout l’espace qui les contient. Les gaz n’ont pas non plus de forme fixe ni de volume fixe et sont très insensibles à la gravité .
More in: État gazeux
Types de gaz et exemples

Les gaz sont généralement classés en fonction de leurs propriétés chimiques, qui peuvent être très diverses, par exemple :
- gaz inertes . Ce sont des gaz à très faible réactivité chimique, comme les gaz nobles .
- Gaz inflammables . Ce sont des gaz facilement inflammables en présence d’ oxygène et de chaleur, c’est pourquoi ils produisent des réactions explosives et exothermiques.
- gaz corrosifs . Ce sont des gaz qui ont une capacité innée à générer de la corrosion, c’est-à-dire dont le pH est si acide ou si basique qu’ils endommagent les surfaces par contact.
Quelques exemples simples de gaz sont : l’air , le méthane (CH 4 ), le dioxyde de carbone (CO 2 ), l’ozone (O 3 ) et l’hélium (He).
Changements de phase en solide
Les changements de phase sont les processus physiques qui convertissent la matière d’un état à un autre, généralement sans altérer ses propriétés chimiques. Voici ceux qui convertissent la matière liquide ou gazeuse en solide :
- solidification . C’est le processus par lequel l’augmentation de la pression d’un liquide le transforme en solide. Au cours de ce processus, les particules du liquide se rapprochent, ce qui provoque l’établissement d’interactions entre elles qui génèrent des structures plus fortes typiques d’un solide.
- Congélation . Il consiste en la transformation d’un liquide en un solide par refroidissement du liquide. C’est ce qui se passe lorsque vous congelez de l’eau.
- Déposition . C’est le processus qui consiste à retirer de l’énergie calorifique à un gaz, ce qui peut faire que ses particules se regroupent et perdent leur énorme vitesse, et deviennent des cristaux solides sans passer au préalable par l’état liquide. Elle est également connue sous le nom de sublimation inverse et se produit généralement au sommet des montagnes , toujours recouvertes de glace.
Changements de phase en liquide

Les processus de changement de phase qui conduisent au passage du solide ou du gaz au liquide sont :
- Fusionner . C’est le processus par lequel la température d’un solide est augmentée jusqu’à ce qu’il devienne un liquide. L’énergie thermique est fournie à la matière solide jusqu’à ce que sa température atteigne son point de fusion, ce qui fait que ses particules gagnent en mouvement et en vitesse, jusqu’à ce qu’elle fonde, coule et devienne liquide. C’est ce qui se fait en métallurgie avec le fer , qui est chauffé jusqu’à ce qu’il fonde.
- liquéfaction _ Il se produit lorsqu’un gaz est soumis à de très hautes pressions, le forçant à devenir liquide, sans changer sa température. C’est ainsi que sont obtenus les gaz liquéfiés, comme le butane liquide et le méthane.
- condensation . Encore une fois, l’élimination de la chaleur (refroidissement) d’un gaz entraîne un déplacement plus lent de ses particules. De cette façon, des interactions entre ses particules sont établies et des gouttes de liquide se forment sur n’importe quelle surface. C’est ce qui se passe avec la vapeur d’eau sur le miroir lorsque nous prenons une douche.
Changements de phase en gaz
Enfin, les changements de phase qui conduisent à l’état gazeux sont :
- bouillant _ Il est produit en introduisant de l’énergie thermique dans un liquide, de sorte que sa température s’élève au-delà de son point d’ébullition : ses particules se mettent à vibrer beaucoup plus rapidement et l’espace entre elles s’agrandit, et la matière liquide se transforme en gaz. Nous pouvons le vérifier lors de l’ébullition de l’eau dans la cuisine.
- évaporation _ C’est le processus par lequel un liquide se transforme en gaz lorsque la température du liquide augmente et se produit lentement. Il n’est pas nécessaire que la température du liquide atteigne le point d’ébullition pour qu’il commence à se transformer en gaz.
- sublimation . Dans certaines conditions de pression et de température, il est possible de mobiliser rapidement les particules d’un solide, pour qu’il devienne directement gazeux, sans passer préalablement par l’état liquide. Cela se produit avec de la neige carbonique (glace CO2) à température ambiante.
L’état plasmatique

Un quatrième état d’agrégation de la matière , constitué d’un gaz ionisé, est appelé plasma . Les atomes de ces gaz ont été débarrassés des électrons et ont donc une charge électrique fixe (anions – et cations +). Pour cette raison, le plasma est un excellent transmetteur d’ électricité .
Il existe deux types de plasma :
- plasma froid . Les électrons sont à une température plus élevée que les ions.
- plasma chaud . Ses atomes ionisés deviennent extrêmement chauds, il génère donc de la lumière et de la chaleur.
Quelques exemples de plasma sont le Soleil , les écrans électroniques ou l’intérieur des tubes d’éclairage fluorescent (comme le néon).
Il peut vous aider à : Séparation des mélanges







