Nous expliquons ce que sont les gaz parfaits, leur classification et les propriétés qu’ils présentent. De plus, ses caractéristiques générales et à quoi elles servent.
Que sont les gaz parfaits ?
Un gaz parfait est appelé un gaz hypothétique ou théorique, qui serait composé de particules qui se déplacent de manière aléatoire et sans interagir entre elles.
Son énergie cinétique est directement proportionnelle à la température . Les collisions entre les molécules qui le composent (entre elles et avec le contenant) sont élastiques, c’est-à-dire qu’elles conservent la quantité de mouvement et l’énergie cinétique.
Il s’agit d’un concept utile qui peut être analysé en faisant appel à la mécanique statistique , à travers une équation d’état simplifiée connue sous le nom de « loi des gaz parfaits ».
De nombreux gaz réels connus en chimie se comportent à température et pression ambiantes comme un gaz parfait, du moins d’un point de vue qualitatif. Cela permet de les étudier en tant que gaz parfaits dans certains paramètres raisonnables.
Cependant, le modèle des gaz parfaits a tendance à échouer lorsque la température est basse et la pression élevée, car dans ces conditions l’interaction des particules de gaz est considérable et les espaces intermoléculaires ne peuvent pas être considérés comme du vide.
Cependant, ce modèle n’est pas adapté aux gaz lourds comme les gaz réfrigérants, mais il fonctionne bien pour les gaz légers comme l’hydrogène moléculaire (H 2 ) et pour certains gaz lourds comme le dioxyde de carbone (CO 2 ).
Voir aussi : Fluides
types de gaz parfaits
Il existe trois types de base de gaz parfaits, selon le type d’approche physique choisie pour leur approche:
- Gaz idéal de Maxwell-Boltzmann . À son tour, il peut s’agir de: gaz parfait thermodynamique classique ou gaz parfait quantique, selon l’approche physique appliquée dans son étude.
- Gaz parfait quantique de Bose . Il est composé de bosons, qui sont un type de particules élémentaires. Par exemple : Les photons, qui sont des particules qui transportent un rayonnement électromagnétique comme la lumière visible , sont un type de boson.
- Gaz parfait quantique de Fermi . Il est composé de fermions, qui sont un autre type de particules élémentaires. Par exemple : les électrons, qui sont l’une des particules qui composent les atomes , sont un type de fermion.
Propriétés des gaz parfaits
Certaines des principales propriétés des gaz parfaits sont :
- Ils ont toujours le même nombre de molécules.
- Ils n’ont pas de forces attractives ou répulsives entre leurs molécules.
- Ils ne peuvent pas subir de transitions de phase (gaz-liquide, gaz-solide).
- Les molécules de gaz parfaits occupent toujours le même volume dans les mêmes conditions de pression et de température.
loi des gaz parfaits

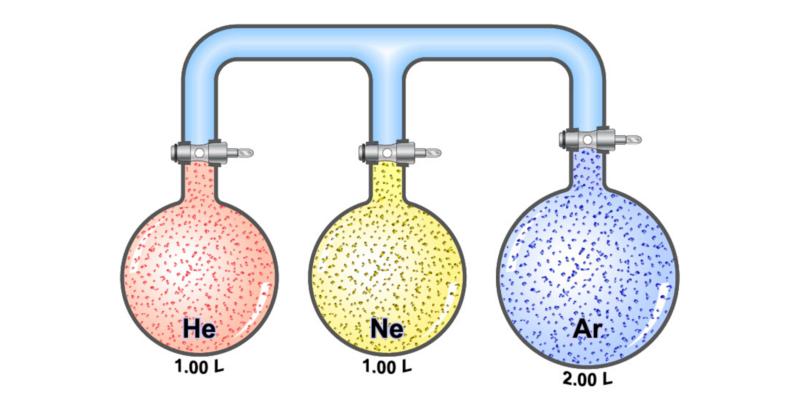
L’état d’une quantité de matière gazeuse est décrit à partir de quatre variables différentes : la pression, le volume, la température et le nombre de moles de gaz.
La relation mathématique idéale entre ces facteurs est précisément la loi des gaz parfaits, qui prédit le comportement de la plupart des gaz réels à température et pression ambiantes.
Cette loi permet de calculer l’une des quatre variables à partir de la connaissance des trois autres, selon l’équation qui l’exprime :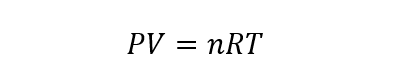
P représente la pression du gaz, V son volume, n le nombre de moles de gaz (qui doit rester constant), R la constante du gaz parfait (égale à 8,314472 J/molK) et T la température du gaz considéré.
Si un gaz respecte cette loi, il peut être traité comme s’il était idéal .
Cette loi est aussi la combinaison des lois de Boyle , de Gay-Lussac, de Charles et d’Avogadro.
La loi de Boyle
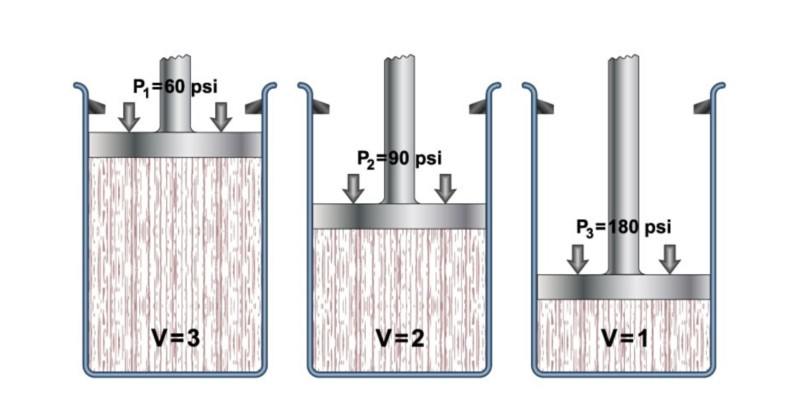
Au XVIIe siècle, le scientifique Robert Boyle a réalisé une série d’expériences utilisant des gaz et des liquides , grâce auxquelles il a déterminé l’effet de la pression sur le volume dans les gaz.
Cela l’a amené à formuler sa loi, qui stipule que « le volume d’un gaz varie en raison inverse de la pression si la température reste constante ».
Ceci est représenté pour les gaz parfaits par l’équation suivante :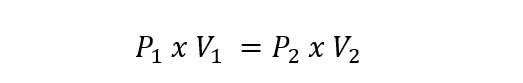
Où P1 et V1 sont la pression et le volume initiaux du gaz, tandis que P2 et V2 sont la pression et le volume finaux.
Loi de Gay-Lussac
Cette loi explique que la pression d’une masse de gaz dont le volume reste constant est directement proportionnelle à sa température (exprimée en kelvin). Il a été élevé par Joseph Louis Gay-Lussac en 1802 .
Pour les gaz parfaits, cette loi est représentée par l’équation :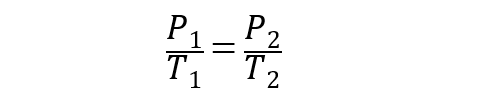
Où P 1 et T 1 sont la pression et la température initiales du gaz, tandis que P 2 et T 2 sont la pression et la température finales.
loi charles
Grâce aux études du français Jacques Charles en 1787, nous avons cette loi qui exprime la relation directement proportionnelle entre la température et le volume d’un gaz , à une certaine pression.
L’équation qui représente cette loi est la suivante :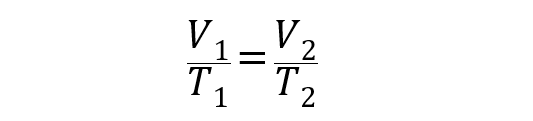
Où V 1 et T 1 sont le volume et la température initiale du gaz, tandis que V 2 et T 2 sont le volume et la température finale.
Loi d’Avogadro
C’est une loi formulée en 1811 par Amadeo Avogadro , qui découvrit que :
« Des volumes égaux de substances gazeuses différentes, mesurés dans les mêmes conditions de pression et de température, contiennent le même nombre de molécules. »
A quoi sert le modèle de gaz idéal ?
La notion de gaz parfait est née de la nécessité de comprendre le fonctionnement de ces fluides , largement utilisés dans l’industrie.
Au lieu de créer un modèle pour chaque type de gaz, on utilise sa formulation idéale , c’est-à-dire un modèle simplifié à partir duquel la plupart des gaz peuvent être étudiés.
gaz parfaits et non parfaits

Les gaz non parfaits sont des gaz réels , c’est-à-dire ceux qui existent dans la vie réelle et dont le comportement n’est pas toujours conforme à ce qui est prédit par la loi des gaz parfaits.
Cela devient plus évident dans le cas des gaz lourds , comme la vapeur d’eau , dont les interactions entre molécules sont très importantes, de sorte que leur comportement ne peut être rapproché de celui d’un gaz parfait. En revanche, d’autres gaz légers (comme l’ hydrogène ) ont tendance à se rapprocher d’un gaz parfait dans des conditions normales de pression et de température.
Continuer avec : Gaz nobles