Nous expliquons ce que sont les hydrocarbures et comment ils sont classés. De plus, quelles sont ses caractéristiques et ses propriétés chimiques et physiques.

Que sont les hydrocarbures ?
Les hydrocarbures sont un groupe de composés organiques . Ses molécules sont composées d’atomes de carbone et d’hydrogène, organisés en différentes structures selon le type d’hydrocarbure.
Pour la plupart, les hydrocarbures proviennent du pétrole . En effet, le pétrole est le résultat de la décomposition de matières organiques et offre donc une grande quantité et concentration de carbone et d’hydrogène .
Les dérivés du pétrole, c’est-à-dire les hydrocarbures, interviennent dans de multiples industries , de l’aéronautique à l’industrie du jouet. La quasi-totalité des carburants utilisés dans les transports sont dérivés des hydrocarbures, usage pour lequel ils créent des déchets polluants ( dioxyde de carbone (CO 2 ) et monoxyde de carbone (CO)). Pour cette raison, des tentatives sont actuellement faites pour les remplacer par d’autres types de combustibles et de sources d’énergie .
Les hydrocarbures sont une ressource non renouvelable , car ils ne peuvent pas être fabriqués par l’homme .
Voir aussi : Polymères
Structure moléculaire organique des hydrocarbures
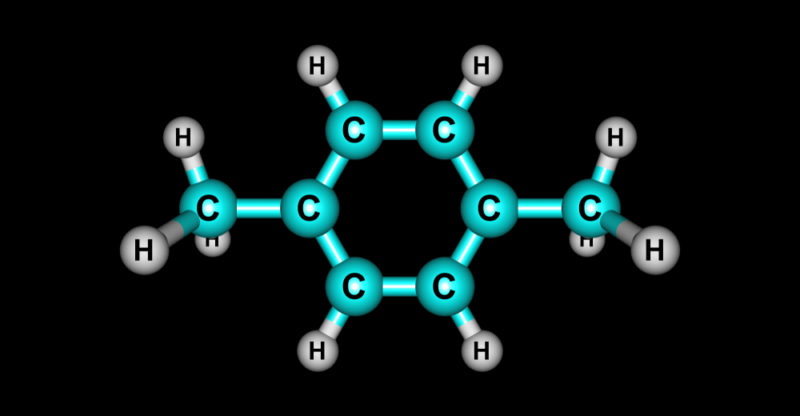
Toutes les substances dont les molécules contiennent dans leur structure principale des atomes de carbone qui forment des liaisons avec d’autres atomes de carbone (liaison carbone-carbone) et avec des atomes d’hydrogène (liaison carbone-hydrogène) sont considérées comme organiques . Cependant, l’oxygène , le soufre , le phosphore et l’azote peuvent également faire partie de sa structure . Les hydrocarbures font partie des molécules organiques, composées uniquement de carbone et d’hydrogène.
Bien que chaque hydrocarbure ait une molécule distincte , ils partagent tous dans leur structure moléculaire une chaîne d’atomes de carbone , chacun pouvant également être lié à un ou plusieurs atomes d’hydrogène.
Types d’hydrocarbures
Hydrocarbures aromatiques
Les hydrocarbures aromatiques ont des molécules cycliques, c’est-à-dire que les atomes de carbone forment un cercle . Entre les atomes de carbone, il y a des doubles liaisons alternant avec des liaisons simples. L’un des hydrocarbures aromatiques est le benzène, ainsi que tous ses dérivés.
Hydrocarbures aliphatiques
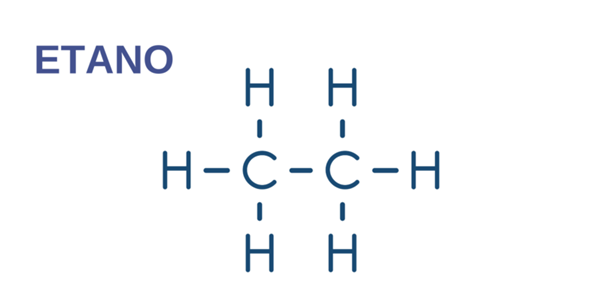
Les hydrocarbures aliphatiques sont ceux qui ne forment pas de cycles avec des doubles liaisons alternées avec des liaisons simples, c’est-à-dire qu’ils ne sont pas aromatiques. Les chaînes aliphatiques peuvent être ouvertes ou fermées.
- Hydrocarbures aliphatiques à chaîne ouverte .
- Alcanes . Les liaisons entre tous les atomes de carbone sont simples. La formule générale est C n H 2n+2 (n est le nombre de carbones).
- Alcènes . Au moins une des liaisons entre les atomes de carbone est double. La formule générale est C n H 2n .
- Alcynes . Au moins une des liaisons entre les atomes de carbone est triple. La formule générale est C n H 2n-2 .
- Hydrocarbures aliphatiques à chaîne fermée . Ils sont dits cycliques et les chaînes d’atomes de carbone forment des anneaux, comme dans le cas des aromatiques. Cependant, les aliphatiques n’ont pas de doubles liaisons alternant avec des simples. Beaucoup sont appelés cycloalcanes.
saturation en hydrocarbures
Une substance est dite saturée lorsque tous les atomes de carbone de sa molécule sont liés à d’autres atomes par des liaisons simples . La molécule est dite saturée car les liaisons simples ne peuvent pas être rompues et donc plus aucun atome d’hydrogène ne peut être ajouté.
Les hydrocarbures saturés sont les alcanes et les cycloalcanes . Les hydrocarbures insaturés sont les aromatiques, les alcènes et les alcynes.
Propriétés physiques des hydrocarbures

- Son point d’ébullition augmente à mesure que la taille de l’hydrocarbure (le nombre d’atomes de carbone) augmente, bien que la géométrie moléculaire de ces molécules influence également. En effet, les forces intermoléculaires sont plus importantes lorsque la molécule est plus grande. Par exemple, le point d’ébullition du butane (C 4 H 10 ) est de 0 °C tandis que le point d’ébullition du nonane (C 9 H 20 ) est de 150,8 °C.
- Sa densité augmente également lorsque la molécule est plus grosse.
- Ils sont insolubles dans l’eau . En effet, ce sont des substances non polaires, c’est-à-dire que les densités de charges électriques dans les différentes régions de chaque molécule s’annulent. D’autre part, l’eau est une molécule polaire, et en chimie l’expression est souvent utilisée : comme se dissout comme.
Propriétés chimiques des hydrocarbures
- combustion . Les hydrocarbures peuvent atteindre une combustion complète ou incomplète (oxydation). Ils commencent à s’oxyder en présence d’oxygène ou en présence d’une source de chaleur. L’une des substances résultant de la combustion complète est le dioxyde de carbone (CO 2 ) et le monoxyde de carbone incomplet (CO). C’est pourquoi les hydrocarbures sont des substances polluantes lorsqu’ils sont utilisés comme carburant.
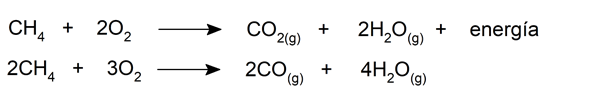
- pyrolyse . C’est la décomposition des composés organiques lorsqu’ils sont chauffés à des températures élevées sans la présence d’oxygène. Par exemple, lorsque des alcanes sont exposés à une température de 800°C, ils peuvent se décomposer en alcènes, en alcanes plus petits et en hydrogène libre.
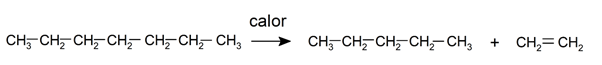
- Halogénation . En présence de lumière , notamment de rayons ultraviolets, les alcanes réagissent avec les halogènes , produisant des dérivés halogénés.
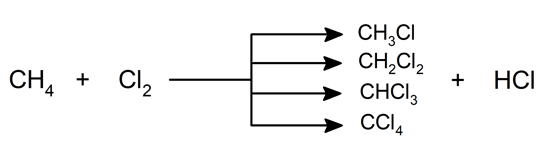
Utilisations des hydrocarbures

Les hydrocarbures sont principalement utilisés comme carburant pour les transports et l’industrie , mais aussi dans les générateurs électriques. De plus, ils sont la matière première des lubrifiants et des graisses pour véhicules, ainsi que des asphaltes.
Les hydrocarbures sont transformés pour fabriquer toutes sortes de plastiques , acryliques, nylon, gants, peintures , fibres synthétiques, contenants, adhésifs, insecticides, détergents, liquides de refroidissement et engrais.
dégradation des hydrocarbures

Les hydrocarbures sont polluants non seulement en raison des résidus produits lors de leur combustion, mais aussi lorsque le pétrole (mélange d’hydrocarbures) est déversé sur terre ou dans l’eau. Bien qu’étant des substances organiques, les hydrocarbures ne sont généralement pas biodégradables .
Cependant, des recherches ont été développées pour résoudre ce problème . Pour cela, on utilise une combinaison de bactéries qui dégradent les molécules d’hydrocarbures en chaîne, c’est-à-dire qu’une bactérie parvient à casser la molécule pour la rendre « comestible » pour une autre bactérie.
Nomenclature des hydrocarbures
Pour nommer les hydrocarbures , une série de préfixes (au début du nom) et de suffixes (à la fin du nom) sont utilisés pour indiquer le nombre de liaisons et d’atomes.
Exemples de préfixes basés sur le nombre d’atomes de carbone : Met (un atome de carbone), Et (deux), Prop (trois), But (quatre), Pent (cinq), Hex (six), Hept (sept), Oct ( huit), Non (neuf).
Suffixes selon le type d’hydrocarbures
- Alcanes : -ane. Par exemple : le butane (alcane à quatre atomes de carbone).
- Alcènes : -ène. Par exemple : le pentène (alcène à cinq atomes de carbone).
- Alcynes : ynon . Par exemple : éthyne (alcyne à deux atomes de carbone).
S’ils sont cycliques, utilisez le préfixe cyclo- suivi du nom de l’hydrocarbure. Par exemple : cyclobutane ou cyclopentane.
Dans le cas des hydrocarbures qui ont des doubles ou triples liaisons, un nombre correspondant à la position du premier carbone qui participe à ces liaisons multiples doit être mis en préfixe au suffixe -ène (s’il s’agit d’un alcène) et au suffixe -yne (si c’est un alcène).alcyne).
Exemples d’hydrocarbures
- méthane . CH 4 (alcane)
- éthane . CH 3 – CH 3 (alcane)
- propane . CH 3 – CH 2 – CH 3 (alcane)
- butane . CH 3 – CH 2 – CH 2 – CH 3 (alcane)
- But-1-yne ou 1-butyne . CH ≡ C – CH 2 – CH 3 (alcyne)
- Hep-3-yne ou 3-heptyne . CH 3 – CH 2 – C ≡ C – CH 2 – CH 3 (alcyne)
Continuer avec : Carbone







