Nous expliquons ce qu’est l’hydrogène et quelles sont ses propriétés atomiques et physiques. En outre, ses caractéristiques générales, ses utilisations et ses risques.

Qu’est-ce que l’hydrogène ?
L’hydrogène est le premier élément du tableau périodique et le plus abondant dans l’ univers connu : il constitue plus des trois quarts de toute la matière observable . C’est un élément léger, avec la forme atomique connue la plus simple, et se présente généralement sous la forme d’un gaz diatomique incolore, inodore et inflammable (H2) .
L’hydrogène a été découvert par le physicien et chimiste britannique Henry Cavendish en 1766 et forme la majeure partie de la masse des étoiles au stade précoce . Notre Soleil , en fait, est une énorme bombe à fusion d’hydrogène dans l’espace. Selon les experts, l’hydrogène aurait été le premier élément à se former de tous et est indispensable à la formation de l’eau (H 2 O).
Aujourd’hui, l’hydrogène est produit industriellement et exploité dans de nombreuses applications , du raffinage des combustibles fossiles au soudage et à la cryogénie.
Voir aussi : Soufre
Caractéristiques de l’hydrogène
- nom . Le mot « hydrogène » vient de l’union des mots grecs hydros (eau) et genos (naissance), donc étymologiquement il signifie « qui donne naissance à l’eau ». Évidemment, cela fait allusion à sa participation à la molécule de ce liquide vital, avec l’oxygène .
- symbole . L’hydrogène est le premier élément du tableau périodique, toujours situé dans le coin supérieur gauche, au-dessus du lithium. Il est représenté par le symbole H. Il convient de noter que l’hydrogène n’a pas de caractéristiques permettant de le classer facilement dans les groupes du tableau, il constitue donc presque toujours son propre groupe. Cependant, il est généralement inclus dans la famille IA (groupe 1).
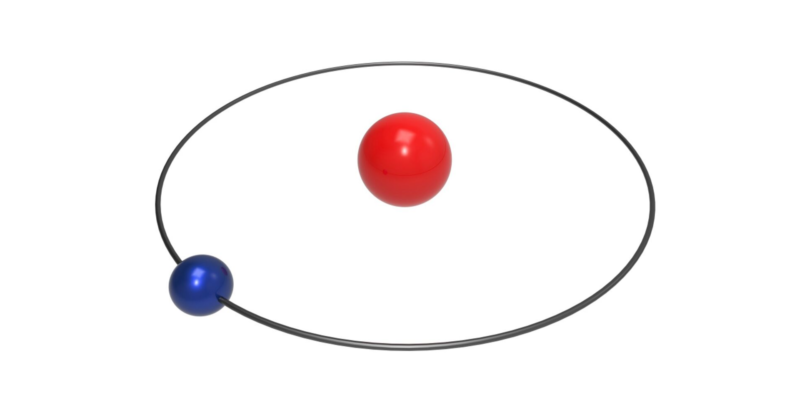
- Propriétés atomiques . L’atome d’hydrogène est l’atome le plus léger connu (masse atomique 1,00794 amu) et possède un seul électron dans son enveloppe externe, sa valence est donc de 1. C’est un atome non métallique hautement oxydable avec un seul proton dans le noyau.
- Propriétés physiques . Dans les conditions ordinaires de pression et de température (1 atm et 25 °C), l’hydrogène se comporte comme un gaz incolore et inodore. Cependant, il est possible de le liquéfier (le rendre liquide ) à des pressions élevées, comme cela se produit au cœur des étoiles, ou dans des réservoirs de réfrigération où l’hydrogène liquide est utilisé comme fluide caloporteur.
- inflammabilité _ L’hydrogène sous sa forme diatomique gazeuse (H) est un gaz hautement inflammable, qui réagit spontanément avec des éléments oxydants tels que l’oxygène, le chlore ou le fluor. De plus, c’est une partie essentielle d’autres matériaux hautement combustibles, tels que les hydrocarbures (hydrogène et carbone ), y compris les combustibles fossiles.
- solubilité . A l’état pur, l’hydrogène est insoluble dans l’eau. Mais, au lieu de cela, il peut être dissous dans divers métaux , ce qui en fait un élément indispensable en métallurgie. Il est très soluble dans les terres rares, dans les métaux de transition et dans les métaux cristallins et amorphes.

abondance d’hydrogène

L’hydrogène représente plus de 70 % de la matière visible de l’univers, ce qui en fait l’élément le plus abondant de tous.
On le trouve dans le cœur des jeunes étoiles , dans l’ atmosphère des grandes planètes gazeuses ( telles que Jupiter et Vénus ), sous forme de traces à la surface de la Terre, et également dans des milliers de composés organiques et inorganiques dans la nature. De nombreux processus biologiques le jettent en conséquence.
isotopes de l’hydrogène
L’hydrogène a plusieurs isotopes (atomes du même élément chimique, mais qui ont des nombres de neutrons différents) :
- Protium ( 1 H) . Composé d’un proton et d’aucun neutron dans son noyau. C’est la version la plus courante de l’hydrogène.
- Deutérium ( 2H ) . Plus lourd que l’hydrogène ordinaire, son noyau a un neutron à côté du proton dans son noyau.
- Tritium ( 3H ) . Il a deux neutrons dans son noyau avec le proton, ce qui le rend encore plus lourd.
Usages et applications de l’hydrogène

Cet élément chimique fait partie d’un large éventail d’industries , tant dans la chimie appliquée (hydrocarbures, engrais, carburants spatiaux), la physique (fusion contrôlée de l’hydrogène pour générer de l’électricité ), que dans d’autres domaines comme la pharmacologie, les transports (ballons, ballons et zeppelins). ) et les semi-conducteurs.
Risques hydrogène
La manipulation de l’hydrogène à l’état pur est extrêmement délicate , car son inflammabilité représente un risque industriel important, ainsi que sa capacité à asphyxier mécaniquement en déplaçant l’oxygène de l’ air . L’hydrogène liquide, un puissant réfrigérant, peut également détruire les tissus organiques.
Suivre avec : Magnésium