Nous expliquons ce qu’est une liaison chimique et les types qui existent. Aussi, quelles sont ses principales caractéristiques et quelques exemples.
Qu’est-ce qu’une liaison chimique ?
La combinaison entre des atomes , des molécules ou des ions qui forment des composés plus complexes dotés de stabilité, altérant leurs propriétés physiques et chimiques, s’appelle une liaison chimique . Une fois unis, deux atomes ou plus constituent un composé chimique.
Les atomes ont tendance à se rassembler pour atteindre des conditions plus stables que seuls , complétant leurs charges électriques par le partage d’électrons de leur orbite atomique la plus externe, ainsi qu’en abandonnant ou en acceptant des électrons pour former des ions (positifs ou négatifs) qui deviennent plus tard électrostatiquement attirés par l’un l’autre.
En effet, les protons du noyau atomique sont chargés positivement et les électrons qui les entourent sont chargés négativement, de sorte que les atomes ont tendance à être configurés de la manière la plus neutre possible.
Il existe différents types de liaisons chimiques, selon le type d’atomes liés, qui ont leurs propres mécanismes de liaison : jusqu’à présent , les liaisons covalentes, ioniques et métalliques sont connues et acceptées, mais il existe d’autres théories et approches.
Voir aussi : Alcènes
Types de liaison chimique
Il existe trois principaux types de liaison chimique :
- Liaison covalente . Cela se produit lorsque des atomes non métalliques d’électronégativités similaires (généralement élevées) se réunissent pour partager des électrons de leur dernière orbite et forment un composé chimique stable.
- liaison ionique . Il consiste en l’union d’atomes métalliques et non métalliques, par un transfert d’électrons du métal vers le non-métal . Ainsi se forment des ions chargés électriquement, cations (+) et anions (-), qui s’attirent électrostatiquement les uns aux autres, constituant la liaison et formant les différents composés chimiques ioniques. Les atomes qui forment ce type de liaison ont une grande différence d’électronégativité.
- Liaison métallique . C’est celui qui se produit entre les atomes métalliques d’un même élément à l’état solide , qui constituent des structures extrêmement compactes et proches les unes des autres. C’est une liaison primaire et forte, dans laquelle les noyaux atomiques se rejoignent entourés de leurs électrons comme dans un nuage.
Caractéristiques d’une liaison chimique
Polarité
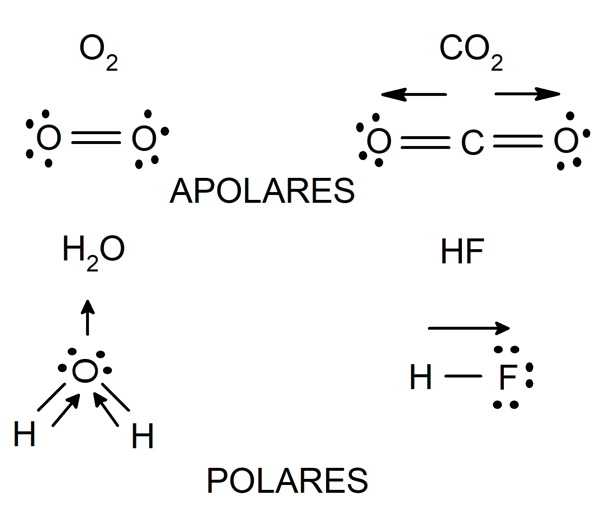
La polarité est une caractéristique des molécules formées par des liaisons covalentes, et elle dépend directement de la nature des atomes liés .
Si deux atomes d’un même élément sont liés , il n’y aura pas de différence entre l’électronégativité de chacun. De cette manière, la paire d’électrons qu’ils partagent sera attirée par chacun de ces atomes avec la même force, de sorte que la répartition des charges électriques sera uniforme dans la molécule qu’ils forment.
La même chose se produit lorsque des atomes d’éléments différents sont liés , mais dont la différence d’électronégativité est très faible (inférieure à 0,4). Les molécules ainsi formées sont appelées « non polaires ou non polaires » et ce type de liaison est appelé « liaison covalente non polaire ».
D’autre part, si deux atomes d’éléments différents sont liés , et la différence d’électronégativité entre eux est supérieure à 0,4 , alors l’atome le plus électronégatif attire les électrons de liaison vers lui avec une plus grande force, générant une distribution de charge non uniforme dans le structure de la molécule qu’ils forment. Les molécules formées par ce processus sont appelées « polaires » et ce type de liaison « liaison covalente polaire ».
Électrovalence
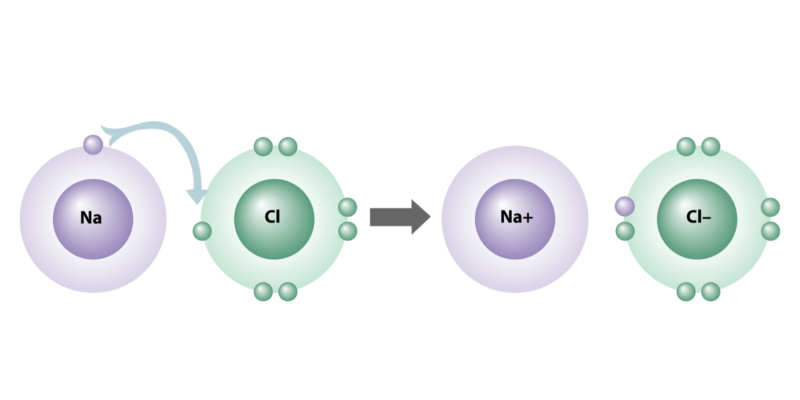
Les liaisons ioniques sont caractérisées parce que leurs atomes ont une grande différence d’électronégativité (supérieure à 2) , dans la mesure où l’un perd et l’autre reçoit des électrons lors de la jonction.
Cette capacité électrique dans les atomes est connue sous le nom d’électrovalence, car certains éléments sont naturellement plus susceptibles d’être des « donneurs » d’électrons (groupes IA, IIA, IIIA du tableau périodique) et d’autres ont plutôt tendance à être des « accepteurs ». » ( groupes VA, VIA et VIIA).
mer d’électrons
Le phénomène qui se produit entre des atomes métalliques de même type soumis à des liaisons métalliques est appelé la « mer d’électrons » . On peut voir comme si les noyaux atomiques étaient immergés dans une mer de leurs électrons.
Les métaux ont une faible électronégativité, sont brillants et malléables , conditions dues à la nature de la liaison qui les maintient ensemble à l’état solide : un ordre rigide qui déplace les électrons de valence de leurs orbitales, permettant une grande conduction de l’ électricité et chaleur et la capacité de renvoyer presque toute la lumière qui les frappe.
rompre les liaisons chimiques

Les liaisons chimiques peuvent être rompues sous certaines conditions, lorsqu’elles sont soumises à l’action de la chaleur , de l’électricité ou d’autres substances qui rompent l’union et permettent la libération de ses atomes impliqués.
Ainsi, par exemple, en appliquant de l’électricité à l’eau, l’ hydrogène et l’oxygène qui la composent peuvent être séparés dans un processus appelé « électrolyse ». D’autre part, en augmentant fortement la température (fournissant de la chaleur) d’une protéine , celle-ci peut être dénaturée et ses liaisons constitutives rompues.
Liaisons hydrogène
Une liaison hydrogène est l’union d’un atome électronégatif avec un autre hydrogène qui est, à son tour, lié de manière covalente à un autre atome électronégatif, formant un « pont » entre deux atomes qui ne pourraient normalement pas se joindre.
Il s’agit cependant d’un type de liaison à force faible, mais qui permet la composition de molécules complexes, leur conférant une grande stabilité, aussi bien dans les substances organiques qu’inorganiques.
Il existe également des liaisons hydrogène entre différentes molécules d’un même composé chimique. Par exemple, les molécules d’ eau forment des liaisons hydrogène entre les atomes d’oxygène et d’hydrogène.
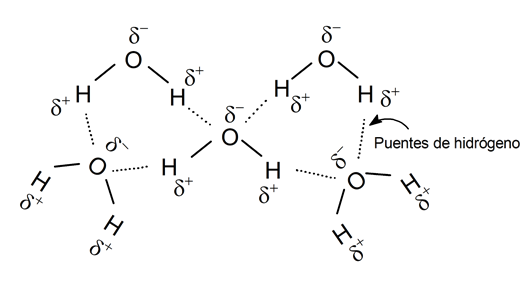
doubles et triples liaisons
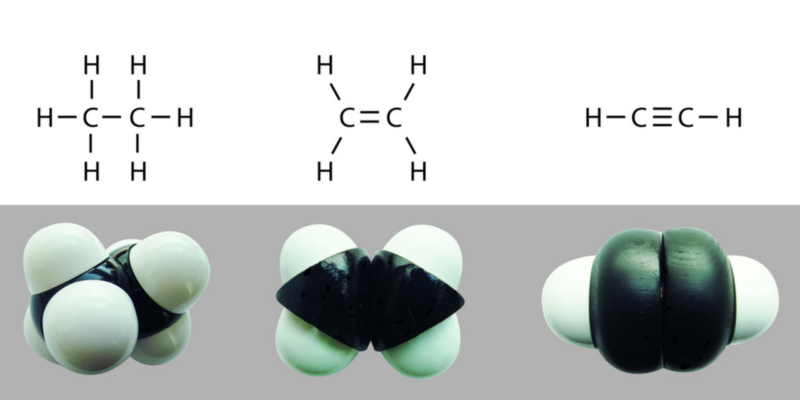
Les liaisons covalentes peuvent être simples, doubles ou triples, selon le nombre de paires d’électrons partagés entre les atomes qui les composent . Plus il y a d’électrons partagés, plus la liaison est forte et plus il faudra d’ énergie pour la rompre.
Les liaisons simples sont représentées graphiquement par une seule ligne AA, les doubles liaisons par deux A=A et les triples liaisons par trois A≡A.
Exemples de composés avec des liaisons covalentes
La liaison covalente est extrêmement courante dans le monde de la chimie organique . Par exemple, il est présent dans des substances telles que :
- Benzène ( C6H6 ) _
- Méthane (CH 4 )
- Glucose ( C6H12O6 ) _ _ _
- Ammoniac ( NH3 )
- Chlorofluorocarbures (« Fréon ») (CFC)
- Diamants, graphites et autres formes de carbone (C)
Exemples de composés avec des liaisons ioniques
De nombreuses substances ont des liaisons ioniques dans leurs composés, telles que :
- Oxyde de magnésium (MgO)
- Sulfate de cuivre (II) (CuSO 4 )
- Iodure de potassium (KI)
- Chlorure de manganèse (MnCl 2 )
- Carbonate de calcium (CaCO 3 )
- Sulfure de fer(III) ( Fe2S3 )
Origine du concept

Depuis l’Antiquité, on soupçonne que les éléments constitutifs de la matière se groupent selon certaines formes d’affinité. Mais c’est en 1704 qu’Isaac Newton postulera sa théorie de la liaison chimique , basée sur les théories atomiques déjà formulées, et constatant qu' »une force » maintenait les atomes ensemble dans les réactions chimiques observées.
En 1819, grâce à l’invention de la pile voltaïque, Jöns Jakob Berzelius introduit les notions d’électropositivité et d’électronégativité dans la théorie de la combinaison atomique, et plus tard, au XXe siècle , Gilbert Lewis introduit le concept de la liaison formée par une paire de électrons. , donnant lieu à la possibilité de liaisons simples, doubles et triples, puisque les atomes pourraient partager entre un et six électrons. C’est ainsi que des liaisons covalentes sont apparues.
En 1927, une théorie similaire à celle de Lewis est également apparue , mais dans laquelle un transfert total d’électrons s’est produit, et a été proposée par Walther Kossel. Cela donnerait naissance à des liaisons ioniques.
Continuer avec : Forces intermoléculaires