Nous expliquons ce que sont les lois de la thermodynamique et comment elles sont développées. Aussi, quelles sont ses caractéristiques et exemples.
Quelles sont les lois de la thermodynamique ?
On appelle lois de la thermodynamique ou principes de la thermodynamique un ensemble de formulations qui caractérisent les systèmes thermodynamiques à partir de leurs grandeurs physiques fondamentales : température , énergie et entropie.
Les systèmes thermodynamiques sont appelés une partie de l’ univers qui est théoriquement isolée pour pouvoir l’étudier.
Il existe quatre lois de la thermodynamique , numérotées de zéro à trois. Ils décrivent comment ces systèmes fonctionnent dans diverses circonstances et contextes, et interdisent l’existence de certains phénomènes, comme le mouvement perpétuel.
Ce sont les formulations les plus élémentaires de cette branche de la physique.
Voir aussi: Loi de Murphy
Qu’est-ce que la thermodynamique ?
La thermodynamique est une branche de la physique dédiée à la description des états d’équilibre des systèmes physiques au niveau macroscopique, c’est-à-dire ceux dont les caractéristiques sont déterminables par des éléments internes et non par des forces externes agissant sur eux. Pour cette raison, il considère que l’énergie ne peut être échangée d’un système à l’autre que sous forme de chaleur ou de travail.
histoire de la thermodynamique
Le premier principe thermodynamique à être établi fut le travail de Nicolás Léonard Sadi Carnot en 1824 , qui fut plus tard appelé la deuxième loi de la thermodynamique.
En 1860, ce principe a été exprimé par Rudolf Clausius et William Thompson , ainsi que ce qui est devenu plus tard la première loi de la thermodynamique.
La troisième, plus moderne, a été proposée par Guggenheim et Fowler et appelée la « Loi Zéro » en 1930, bien qu’elle ne soit pas reconnue comme telle dans tous les domaines.
Loi zéro de la thermodynamique
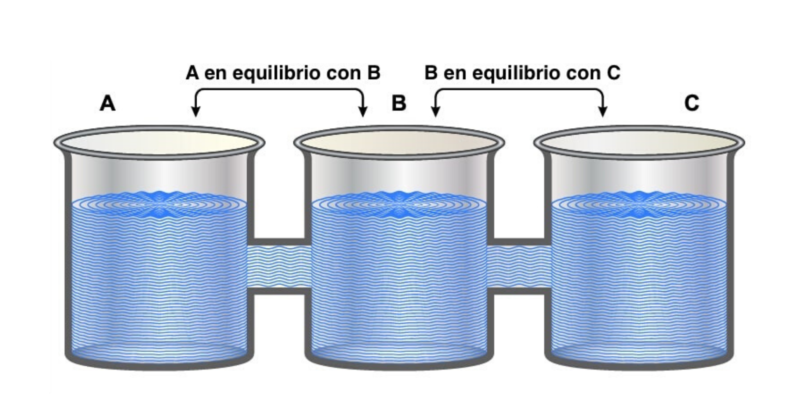
La « loi zéro » est ainsi appelée car bien qu’ayant été la dernière à être postulée , elle établit des préceptes fondamentaux pour les trois autres.
Il stipule que « si deux systèmes sont indépendamment en équilibre thermique avec un troisième système, ils doivent également être en équilibre thermique l’un avec l’autre ».
Cela peut être logiquement exprimé comme si A = C et B = C, alors A = B .
Première loi de la thermodynamique
Également connue sous le nom de « loi de conservation de l’énergie » , elle établit que dans tout système physique isolé, la quantité totale d’ énergie sera la même au fil du temps , bien qu’elle puisse être transformée en d’autres formes d’énergie.
En d’autres termes : « dans un système isolé, l’énergie ne peut être ni créée ni détruite, seulement transformée » .
Une autre façon d’énoncer cette loi est à travers la relation entre la chaleur (Q) qu’un système thermodynamique reçoit ou dégage, le travail effectué ou reçu par celui-ci, et son énergie interne. En fournissant une quantité donnée de chaleur à un système, son énergie interne (ΔU) sera égale à la différence entre cette quantité de chaleur et le travail (W) que le système effectue sur son environnement.
C’est-à-dire : Q = Δ U + W, ou ce qui revient au même : Δ U = Q – W .
Cette formulation stipule que la différence entre l’énergie du système et le travail effectué sera libérée du système sous forme de chaleur.
Exemple de la première loi de la thermodynamique

Imaginez le moteur d’une voiture . L’essence est un système thermodynamique qui réagit avec l’oxygène en générant une étincelle qui produit une combustion. Cette réaction déplace un piston responsable du mouvement des roues de la voiture (travail). De plus, l’ensemble du processus génère de la chaleur qui sort par le tuyau d’échappement.
Si nous pouvions mesurer la quantité de carburant consommée, la quantité de travail effectué et la quantité de chaleur dégagée, nous conclurions que l’énergie dans le moteur est restée constante dans le temps (aucune énergie n’a été créée ou détruite).
Deuxième loi de la thermodynamique
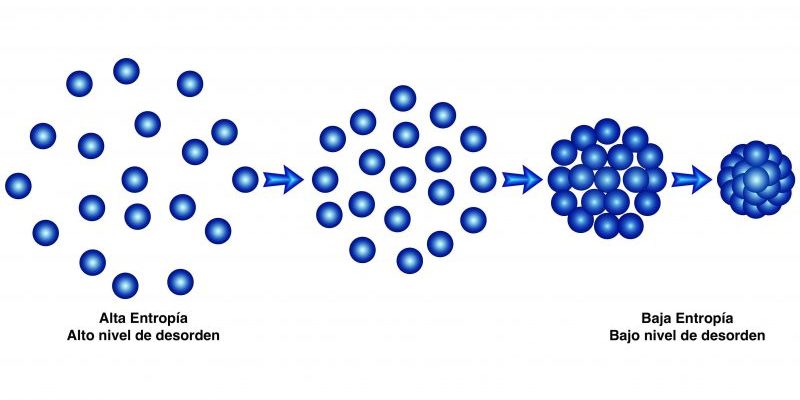
Ce deuxième principe stipule que « la quantité d’entropie dans l’univers tend à augmenter avec le temps » , c’est-à-dire que le désordre de tous les systèmes augmente jusqu’à ce qu’ils aient atteint l’équilibre.
En d’autres termes : avec suffisamment de temps, tous les systèmes tendent vers l’équilibre, qui est l’état de désordre maximal, d’entropie maximale.
Cette loi postule l’irréversibilité des phénomènes physiques , et introduit la fonction d’état d’entropie (S).
Tout comme la première loi concerne les différentes énergies impliquées dans un processus, la seconde loi impose des restrictions sur sa direction et une limite supérieure sur l’efficacité d’un moteur thermique. Cela signifie qu’aucune machine qui convertit la chaleur en travail ne peut le faire avec une efficacité de 100 %. Ainsi, la deuxième loi est extrêmement importante pour de nombreuses applications dans la vie quotidienne et pour l’industrie .
Ce principe est aussi classiquement formulé comme le changement d’entropie (dS) sera toujours égal ou supérieur au transfert de chaleur (Q), divisé par la température (T) de la source qui fournit ou absorbe cette chaleur : dS ≥ δQ /t
Exemple de la deuxième loi de la thermodynamique
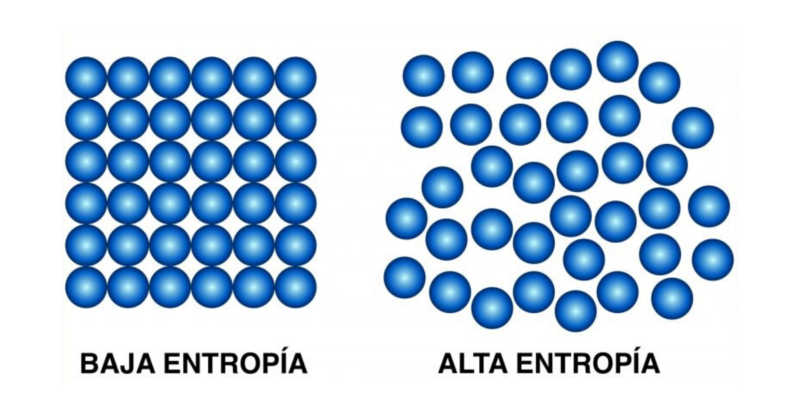
Puisque cette loi détermine l’irréversibilité des phénomènes physiques , il est possible de la vérifier facilement. Si l’on met en contact deux corps de températures différentes, au bout d’un certain temps l’entropie augmentera et leurs températures seront égales. Si nous séparons les corps, les deux maintiendront ces températures d’équilibre et ne reviendront pas naturellement à celles d’origine. Le processus est irréversible.
Troisième loi de la thermodynamique
Également connue sous le nom de postulat de Nerst , cette loi stipule que l’entropie d’un système ramené au zéro absolu est une constante définie :
- En atteignant le zéro absolu (0 K), les processus des systèmes physiques s’arrêtent.
- En atteignant le zéro absolu (0 K), l’entropie aura une valeur minimale constante.
Exemple de la troisième loi de la thermodynamique

S’il est difficile d’atteindre au quotidien des températures proches du soi-disant zéro absolu (-273,15 °C, une valeur qui n’a encore jamais été atteinte), ce principe peut être illustré par ce qui se passe dans notre congélateur : la viande et les aliments que nous y déposons, ils seront portés à des températures très basses, pour ralentir ou même pratiquement arrêter les processus biochimiques à l’intérieur, retardant leur décomposition et maximisant leur durée de vie.
Pourquoi les lois de la thermodynamique sont-elles importantes ?
Ces quatre préceptes thermodynamiques décrivent le fonctionnement des systèmes thermodynamiques et, par conséquent, offrent un guide applicable à la compréhension, au moins théorique, de la physique universelle.
Ils sont le résultat de la capacité d’analyse de l’ être humain (pas d’expérimentation, ce sont des principes théoriques) et en même temps ils sont le support d’analyses et de considérations futures en la matière .