Nous expliquons ce que sont les métalloïdes et à quoi ressemblent leurs formes et leurs couleurs. Aussi, quelles sont ses caractéristiques, ses propriétés et ses utilisations.
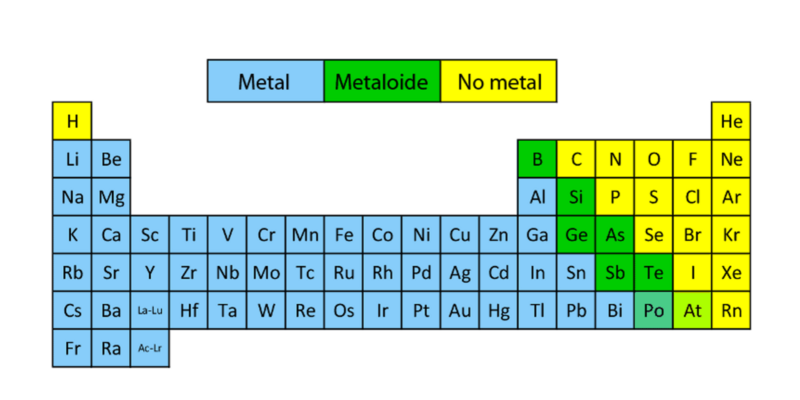
Que sont les métalloïdes ?
Les métalloïdes ou semi-métaux sont un type d’ éléments chimiques qui présentent un comportement intermédiaire entre les métaux et les non-métaux , en termes d’énergies d’ionisation et de propriétés de liaison.
Il n’est pas facile de les distinguer des vrais métaux . Ils conduisent mieux le courant électrique que les non-métaux, mais ils ne sont pas aussi bons conducteurs que les métaux. De plus, ils sont généralement très variés dans leur forme et leur coloration .
La liste des métalloïdes comprend les éléments suivants :
- Bore (B)
- Silicium (Oui)
- Germanium (Ge)
- Arsenic (As)
- Antimoine (Su)
- Tellure (Te)
- Polonium (Po)
Voir aussi: Métaux alcalins
Caractéristiques des métalloïdes

- Emplacement sur le tableau périodique . Les métalloïdes se trouvent, au sein du tableau périodique, dans une diagonale descendante du bore au polonium, dispersés entre les colonnes 13, 14, 15 et 16, et divisant le tableau en deux. Les éléments situés au milieu de la droite sont non métalliques et ceux situés à gauche sont métalliques.
- Forme et coloration . Les métalloïdes sont très variés en termes de forme et de couleur. Ils peuvent être brillants ou opaques, et nombre d’entre eux présentent plus d’un état allotropique, c’est-à-dire des présentations différentes selon leur structure moléculaire. L’arsenic, par exemple, peut être gris, jaune ou noir, selon son allotrope. De même, le silicium peut apparaître sous la forme d’un cristal solide brillant ou d’une poudre brunâtre et amorphe.
- Conduite électrique . La plupart des métalloïdes sont des semi-conducteurs (ils peuvent se comporter comme des conducteurs ou des isolants, transmettant mieux l’électricité dans un sens que dans l’autre) plutôt que des conducteurs complets, et en cela ils diffèrent des éléments métalliques. Cependant, ce sont de bien meilleurs conducteurs que les non-métaux (isolants), c’est pourquoi ils sont souvent utilisés dans l’industrie de la fabrication électronique.
- conduction thermique . Les métalloïdes conduisent beaucoup mieux l’énergie thermique que les non-métaux, sans atteindre la conductivité élevée des métaux. En général, ils ne sont pas considérés comme de bons conducteurs de chaleur.
- réactivité . Compte tenu de leur état intermédiaire, les métalloïdes réagissent différemment selon qu’ils sont en présence d’un élément métallique (alors ils réagissent comme un non-métal) ou d’un élément non métallique (alors ils réagissent comme un métal). Ils ont une affinité pour divers éléments, en fonction de chacun, et pour cette raison, ils se trouvent généralement dans les minéraux avec eux, tels que l’uranium, le plomb , le soufre , etc.
- toxicité . Bien que certains métalloïdes soient indispensables à la formation de molécules vitales (par exemple l’arsenic, que l’on retrouve dans le corps des êtres vivants ), il est possible qu’ils représentent un danger pour la santé. L’empoisonnement au bore ou l’arsenic lui-même (extrêmement toxique) peut être mortel; et pour sa part, le polonium est un élément toxique et hautement radioactif, c’est-à-dire qu’il émet des particules alpha nocives pour la santé, potentiellement cancérigènes, immunosuppressives et mutagènes.
États d’agrégation des métalloïdes

La plupart des métalloïdes apparaissent généralement solides à température ambiante , sous forme de cristaux (comme l’arsenic) ou de blocs cassants et opaques (comme le germanium).
Cependant, certains ont de curieuses propriétés en termes de changement de phase. Par exemple, l’arsenic passe directement d’ un solide à un gaz (sublimation) en présence de chaleur (et à des pressions atmosphériques normales).
Propriétés atomiques des métalloïdes

Les métalloïdes sont très divers dans leur caractérisation atomique. Il y en a de grande masse atomique comme le polonium (209 u) ou l’antimoine (121,76 u), et d’autres plutôt légers comme le bore (10,81 u) et le silicium (28,08 u).
Il en va de même avec leurs densités, qui vont de 2,37 g/cm 3 (bore) à 9,32 g/cm 3 (polonium) et avec leur configuration électronique, qui peut avoir un nombre différent d’électrons dans la dernière couche : 3 (bore ), 4 (silicium, germanium), 5 (arsenic, antimoine) et 6 (tellure, polonium).
Abondance de métalloïdes
Certains métalloïdes sont extrêmement abondants dans la croûte terrestre , comme le silicium, qui forme de nombreux composés appelés silicates, ou arsenic.
Le bore, pour sa part, existe en abondance, mais dans le cadre du minéral appelé borax, puisqu’il n’existe pas à l’état libre et pur dans la nature.
Le polonium, en revanche, est assez rare et n’apparaît que dans certains minerais d’uranium; et l’antimoine se trouve en très faibles pourcentages dans la croûte terrestre.
Utilisations des métalloïdes

La plupart des semi-métaux sont utilisés pour la fabrication de dispositifs électroniques et d’éléments semi-conducteurs, tels que des redresseurs, des transistors, des diodes, des circuits intégrés ou même (comme dans le cas du silicium), des puces et des microprocesseurs . Cependant, leur variété leur permet de nombreuses utilisations différentes.
Par exemple, certains isotopes du bore sont utiles dans l’absorption des neutrons à l’intérieur des centrales nucléaires et fonctionnent comme des mécanismes de régulation des réactions atomiques.
Continuer avec : Gaz nobles