Nous expliquons ce que sont les métaux, comment ils sont classés et les propriétés qu’ils possèdent. Aussi, quelles sont ses caractéristiques, exemples et plus encore.

Que sont les métaux ?
Les éléments métalliques sont ceux qui sont solides à température ambiante (sauf le mercure). De plus, ce sont de bons conducteurs de chaleur et d’électricité .
Les éléments métalliques sont les plus abondants dans la croûte terrestre : sur les 118 éléments qui composent le tableau périodique, seuls 25 sont non métalliques. On les trouve généralement naturellement dans des proportions plus ou moins pures, faisant partie des minéraux du sous-sol terrestre, dont il faut les séparer.
L’étude et l’utilisation des métaux par l’homme , à travers des processus physiques de mélange, de coulée et de moulage , est connue sous le nom de métallurgie. C’est l’un des principaux fondements de l’ingénierie.
Voir aussi : Ventes
classification des métaux

Les éléments métalliques sont classés en différents types, tels qu’ils apparaissent dans le tableau périodique. Chaque groupe présente des propriétés exclusives.
- métaux alcalins . Ils sont situés dans le groupe 1 du tableau périodique. Ils sont brillants, doux et très réactifs dans des conditions normales de pression et de température , c’est pourquoi ils forment toujours des composés chimiques et jamais libres. Ils ont de faibles densités et sont de bons conducteurs de chaleur et d’électricité.
- Métaux alcalino-terreux . Ils sont situés dans le groupe 2 du tableau périodique. Son nom vient du fait que ses oxydes (anciennement appelés « terres ») ont des propriétés alcalines. Ils sont plus durs et moins réactifs que les alcalins, brillants et bons conducteurs de chaleur et d’électricité, en plus d’avoir une faible densité et souvent des couleurs.
- Métaux de transition . Ils sont situés dans des groupes allant de 3 à 12 du tableau périodique. La plupart des métaux sont de transition. Presque tous sont durs, ont des points de fusion et d’ébullition élevés et également une bonne conduction de la chaleur et de l’électricité.
- Lanthanides . Ils sont situés dans la période 6 du tableau périodique. Appelés lanthanoïdes ou « terres rares », ils forment avec les actinides les « éléments de transition internes ». Ce sont des éléments très semblables les uns aux autres et très abondants à la surface de la terre. Ils ont des comportements magnétiques uniques.
- Actinides . Ils sont situés dans la période 7 du tableau périodique. Ce sont des métaux avec des numéros atomiques élevés, beaucoup d’entre eux ont tous leurs isotopes radioactifs. Certains sont extrêmement rares dans la nature.
- transactinides _ Ce sont des métaux « super-lourds », qui dépassent en nombre atomique le plus lourd des actinides : le lawrencium (Z=103). Tous ses isotopes ont une demi-vie très courte, car ils sont très radioactifs et ne sont obtenus que par synthèse en laboratoire.
Propriétés physiques des métaux

Les métaux ont des propriétés physiques particulières, telles que :
- malléabilité _ De nombreux métaux, lorsqu’ils sont soumis à une compression, peuvent former des feuilles minces et homogènes du même matériau .
- ductilité . De nombreux métaux, lorsqu’ils sont soumis à une tension, forment des fils ou des brins de matériau homogènes.
- ténacité . De nombreux métaux sont capables de résister à la rupture lorsqu’ils sont soumis à des forces soudaines telles que des coups ou des chutes. Plus un métal est dur, moins il est susceptible de se casser.
- résistance mécanique . De nombreux métaux sont capables de résister à la tension, à la compression, à la torsion et à d’autres forces similaires sans céder dans leur structure physique (déformation).
- conductivité . Les métaux sont capables de permettre le passage d’un courant d’électrons à travers leur surface (électricité) ou d’énergie thermique (chaleur).
- Ce sont de bons conducteurs thermiques et électriques.
- Ils ont des densités élevées.
- Ils sont généralement solides à température ambiante (à l’exception du mercure).
- Presque tous réfléchissent la lumière (photons), ce qui leur donne un éclat très caractéristique.
Propriétés chimiques des métaux
- Ils forment des cations (ions chargés positivement).
- La plupart forment des oxydes lorsqu’ils sont combinés avec de l’oxygène.
- Les métaux alcalins explosent au contact de l’eau.
liaison métallique
La dureté des métaux est due à un type de liaison atomique caractéristique de leurs formations naturelles . Ce sont des liaisons métalliques (entre atomes d’un même élément métallique).
Ces liaisons métalliques maintiennent ensemble les atomes d’un même type de métal , formant des structures régulières de forme définie et, généralement, solides. Les atomes ainsi liés permettent la libre circulation des électrons vers et depuis les atomes voisins (comme dans un nuage d’électrons), c’est pourquoi les métaux sont de si bons conducteurs électriques et thermiques.

A quoi servent les métaux ?

Les métaux sont utiles à l’humanité depuis l’Antiquité . Leurs propriétés physiques les rendent idéales pour créer des outils solides et résistants, des statues ou des structures architecturales de toutes sortes.
En raison de leur résistance mécanique, ils ont été utilisés pour fabriquer des machines et des pièces résistantes à de grandes quantités de force. Des lances et des boucliers aux tractopelles et aux ordinateurs personnels , les métaux ont été des éléments fondamentaux dans le développement de la modernité .
D’autre part, leur brillance les rend idéales pour forger des bijoux et des éléments ornementaux , du moins en ce qui concerne les métaux précieux. Il en va de même pour leur bonne conduction de l’électricité, ce qui les rend indispensables dans les systèmes électroniques et informatiques.
Importance biologique des métaux
Les métaux ne sont pas des éléments organiques, c’est-à-dire qu’ils ne font pas directement partie des structures moléculaires de la vie (comme le sont certains non-métaux). Pourtant, ils sont indispensables à la continuité de la vie , puisque de nombreuses réactions organiques les nécessitent ainsi que leurs propriétés exclusives.
Par exemple, les systèmes nerveux et neuronal nécessitent des métaux conducteurs , comme le lithium et le fer, bien que dans des proportions très modestes. De la même manière, la conduction de l’oxygène dans le sang est assurée grâce à l’hémoglobine, une protéine qui possède des atomes de fer.
les alliages de métaux

Les alliages sont des mélanges homogènes de métaux . En eux, aucune réaction chimique n’a lieu et, par conséquent, il n’y a pas de formation de nouveaux composés chimiques. D’autre part, chaque alliage ajoute les propriétés des différents composants du mélange .
Les alliages sont des méthodes physiques de combinaison de métaux ou de métaux et de non-métaux , réalisées à haute température. C’est ainsi que de nouveaux matériaux sont obtenus, par exemple:
- acier . Alliage de fer et de carbone et d’autres éléments en moindre proportion.
- bronze . Alliage de cuivre et d’étain .
- laiton . Alliage de zinc et de cuivre .
- duralumin . Alliage d’ aluminium et de cuivre .
- acier inoxydable . Du nickel et du chrome sont ajoutés à l’alliage d’acier.
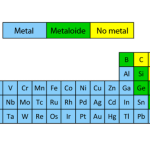
métalloïdes
Aussi appelés semi-métaux, ce sont des éléments qui ont un comportement intermédiaire entre les métaux et les non-métaux et qui possèdent les propriétés des deux. Par exemple, ils sont de meilleurs conducteurs que les non-métaux, mais moins bons que les métaux. De plus, ils ont tendance à imiter la réaction des métaux lorsqu’ils se rencontrent avec des atomes non métalliques.
Ce sont des métalloïdes : le bore (B), le silicium (Si), le germanium (Ge), l’arsenic (As), le tellure (Te), le polonium (Po) et l’antimoine (Sb).
More in: Métalloïdes
Différences entre les métaux et les non-métaux

Les éléments non métalliques sont essentiels à la vie organique et appartiennent, pour la plupart, aux soi-disant halogènes , gaz nobles et autres groupes divers du tableau périodique. Ils diffèrent des métaux car :
- Ce ne sont pas de bons conducteurs de chaleur ou d’électricité.
- Ils ne sont pas brillants.
- Ils peuvent former des liaisons covalentes et ioniques.
- Ils sont cassants, ils ne peuvent donc pas être étirés pour former des fils ou compressés pour former des feuilles.
Ce sont des non-métaux : oxygène (O), carbone (C), hydrogène (H), azote (N), phosphore (P), soufre (S), fluor (F), chlore (Cl), brome (Br) , Iode (I), Astatine (At), Tenesus (Ts), Hélium (He), Néon (Ne), Argon (Ar), Krypton (Kr), Xénon (Xe) et Radon (Rn).
exemples de métaux

- alcaline . Lithium (Li), Sodium (Na), Potassium (K), Rubidium (Rb), Césium (Cs), Francium (Fr).
- alcalino -terreux Béryllium (Be), magnésium (Mg), calcium (Ca), strontium (Sr), baryum (Ba) et radium (Ra).
- Métaux de transition . Scandium (Sc), yttrium (Y), lutétium (Lu), lawrencium (Lr), titane (Ti), zirconium (Zr), hafnium (Hf), rutherfordium (Rf), vanadium (V), niobium (Nb), tantale (Ta), dubnium (Db), chrome (Cr), molybdène (Mo), tungstène (W), seborgium (Sg), manganèse (Mn), technésium (Te), rhénium (Re), bohrium (Bh), Fer (Fe), Ruthénium (Ru), Osmium (Os), Hasium (Hs), Cobalt (Co), Rhodium (Rh), Iridium (Ir), Meitnerium (Mt), Nickel (Ni), Palladium (Pd), platine (Pt), darmstatium (Ds), cuivre (Cu), argent (Ag), or (Au), roentgenium (Rg), zinc (Zn), cadmium (Cd), mercure (Hg) et copernicium (Cn).
- terres rares . Lanthane (La), Cérium (Ce), Praséodyme (Pr), Néodyme (Nd), Prométhium (Pm), Samarium (Sm), Europium (Eu), Gadolinium (Gd), Terbium (Tb), Dysprosium (Dy), holmium (Ho), erbium (Er), thulium (Tm), ytterbium (Yb) et lutétium (Lu).
- Actinides . Actinium (Ac), Thorium (Th), Protactinium (Pa), Uranium (U), Neptunium (Np), Plutonium (Pu), Américium (Am), Curium (Cm), Berkelium (Bk), Californium (Cf), einsteinium (Es), fermium (Fm), mendelevium (Md), nobelium (No) et lawrencium (Lr).
- transactinides _ Rutherfordium (Rf), dubnium (Db), seaborgium (Sg), bohrium (Bh), hassium (Hs), meitnerium (Mt), darmstatium (Ds), roentgenium (Rg), copernicium (Cn), nihonium (Nh), flerovium (Fl), muscovium (Mc), livermorium (Lv), teneso (Ts), oganeson (Og), saturnium (Sv), unbinulium (Ubn) et superactine (Sac).
Comment les métaux sont-ils apparus ?

À ses débuts, l’ univers était composé d’hydrogène et d’hélium , deux gaz légers . Ces deux gaz fusionnent lors de réactions nucléaires au centre des étoiles . En conséquence, d’énormes quantités d’ énergie sont produites et des noyaux atomiques plus lourds de nouveaux éléments stables sont également composés. C’est ainsi que les éléments métalliques se sont progressivement formés au cœur des étoiles.
Ces éléments lourds, comme le fer (Fe), s’accumulent à l’intérieur des étoiles . Leur présence ralentit la réaction atomique car il manque de carburant, tuant l’étoile. Quand elle se déclenche enfin (une supernova), elle envoie ces éléments aux différents coins de la galaxie qui l’ entourent.
Dans un cadre plus terrestre, nous savons que les métaux proviennent de l’intérieur de notre planète . Le noyau terrestre , par exemple, est constitué de fer pur et de nickel.
Cela peut vous aider : Âge des métaux