Nous expliquons ce que sont les molécules, comment elles sont classées et leurs propriétés. Aussi, quelles sont ses caractéristiques et exemples.

Que sont les molécules ?
Une molécule est appelée un ensemble d’atomes électriquement neutres, structurés et interdépendants qui appartiennent au même élément chimique ou à plusieurs. Par exemple, la molécule de dihydrogène (H 2 ) est constituée uniquement d’atomes d’hydrogène, tandis que la molécule de méthane (CH 4 ) est constituée d’un atome de carbone et de quatre atomes d’hydrogène .
Il existe d’autres composés chimiques qui sont également constitués d’ensembles d’atomes électriquement neutres, mais qui ne sont pas des molécules. Parmi eux se trouvent les minéraux qui composent la Terre , les cristaux ioniques ( sels ) ou covalents et autres matériaux similaires (comme le verre ou les métaux ). C’est-à-dire qu’on ne peut pas parler comme tel d’une molécule de verre, ni de fer , ni d’ aluminium .
Voir aussi : Alcènes
Comment les molécules ont-elles été découvertes ?
L’ idée que la matière est composée de particules indivisibles liées entre elles est aussi ancienne que la Grèce antique , lorsque le philosophe Démocrite l’a proposée.
Cependant, l’hypothèse atomique en termes scientifiques n’a été proposée qu’en 1803 , lorsque le chimiste anglais John Dalton a découvert que la matière se formerait à partir d’unions stables d’ atomes appelées molécules.
La nature des atomes et de ces molécules a été explorée plus tard par des scientifiques ultérieurs tels que Thompson et Rutherford, qui ont jeté les bases de la chimie contemporaine.
La définition d’une molécule a changé au fur et à mesure que la technologie progressait et une étude plus détaillée de la structure atomique et moléculaire est devenue possible.
types de molécules

Les molécules peuvent être classées selon plusieurs critères. Selon la taille et la complexité de sa structure, ils sont classés comme suit :
- Molécules discrètes . Ils ont un nombre défini d’atomes, soit d’éléments différents, soit du même élément, et peuvent être classés en fonction du nombre d’atomes dans leur structure. Ainsi, nous avons monatomique (un atome), diatomique (deux atomes), triatomique (trois atomes), tétraatomique (quatre atomes), etc. Par exemple, le diazote (N 2 ) est une molécule diatomique.
- Macromolécules et Polymères . Ce sont de grandes chaînes moléculaires, constituées de répétitions de molécules plus simples, reliées entre elles pour réaliser des séquences longues et complexes aux propriétés nouvelles et spécifiques. Ces macromolécules sont essentielles au développement de la chimie du vivant . Par exemple, l’ADN et les protéines .
Il est important de préciser que tous les polymères sont des macromolécules, mais que toutes les macromolécules ne sont pas des polymères. Les polymères sont des macromolécules composées d’unités moléculaires plus simples appelées monomères, qui se répètent tout au long de leur structure. D’autre part, les macromolécules sont de grosses molécules qui peuvent ou non avoir une unité monomère répétitive.
Selon leur polarité (séparation des charges dans la structure moléculaire), ils sont classés en :
- Molécules polaires . Ils sont constitués d’atomes qui ont une électronégativité différente. Les électrons dérivent vers l’atome le plus électronégatif, créant une densité de charge négative sur celui-ci et une densité de charge positive sur l’autre atome. Cette séparation des charges sur la molécule entraîne la formation d’un dipôle électrique, c’est-à-dire que la molécule se retrouve avec une certaine charge électrique. Par exemple, l’eau (H 2 O).
- molécules non polaires . Ses atomes ont une électronégativité identique, sans différence dans l’attraction des électrons vers les noyaux atomiques. Ces molécules n’ont pas de charge électrique liée à la répartition inégale de leurs électrons. Par exemple, l’oxygène moléculaire (O 2 ).
Selon l’élément chimique prédominant dans sa structure principale, ils sont classés comme suit :
- Molécules organiques . Sa structure principale est basée sur des atomes de carbone. Ils sont indispensables à la vie. Par exemple, le méthane (CH 4 ) et les acides aminés (constituants protéiques).
- Molécules inorganiques . Sa structure principale n’est pas à base de carbone. Il est important de préciser qu’il existe également des molécules inorganiques avec des atomes de carbone dans leur structure, mais ce n’est pas leur élément principal. Par exemple, le monoxyde de carbone (CO) et l’ammoniac (NH 3 ).
propriétés des molécules

Les principales propriétés des molécules sont :
- polarité . C’est la séparation des charges électriques sur la structure moléculaire, car les électrons sont plus attirés par les atomes les plus électronégatifs. Cette propriété est essentielle pour comprendre la solubilité des substances, car les substances polaires se dissolvent dans les substances polaires, tandis que les substances non polaires se dissolvent dans les substances non polaires, bien qu’il existe toujours des points médians de polarités.
- température de fusion . Température à laquelle un solide se transforme en liquide. Cette propriété dépend de la taille de la molécule.
- Température d’ébullition . Température à laquelle la pression de vapeur d’un liquide est égale à la pression entourant le liquide, puis le liquide se transforme en gaz. Cette propriété dépend de la taille de la molécule, mais aussi de sa géométrie et de ses interactions avec d’autres molécules.
- Tome . Les molécules occupent un certain volume dans l’espace.
- réactivité chimique . Les molécules sont plus ou moins réactives selon les atomes qui les forment, la géométrie de leur structure et les conditions extérieures dans lesquelles elles se trouvent.
- isomérie _ Deux molécules ont une isomérie si elles ont la même quantité de chaque type d’atome, mais dans chacune d’elles ces atomes sont disposés différemment. Autrement dit, ils ont des structures chimiques différentes malgré le même nombre et le même type d’atomes.
forces intermoléculaires
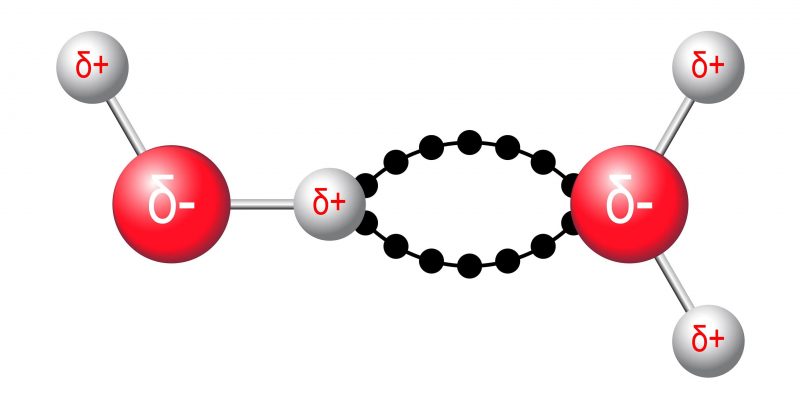
Les forces intermoléculaires sont des interactions qui se produisent entre les molécules. Ils sont généralement basés sur leurs polarités et leur géométrie. Ces forces peuvent être de différents types :
Forces de Van der Waals :
- Dipôle permanent – dipôle permanent . Ils se produisent en raison de l’attraction électromagnétique entre deux molécules polaires.
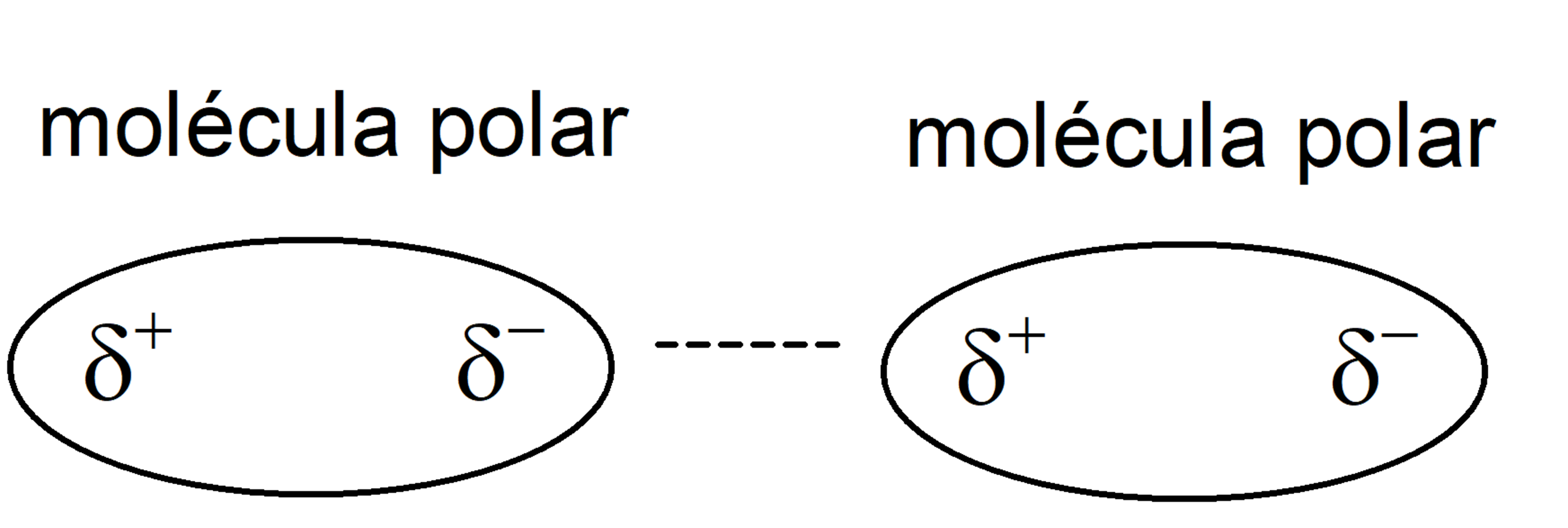
- Dipôle instantané – dipôle induit . Appelées « forces de Londres », elles sont plus faibles et se produisent chez toutes les substances chimiques, lorsque leur nuage électronique est temporairement déséquilibré vers une extrémité de la molécule, la rendant capable d’attirer ou de rejeter les nuages électroniques d’autres molécules proches, et de les transformer par induction sur un dipôle momentané. Ils se produisent généralement entre des molécules non polaires.
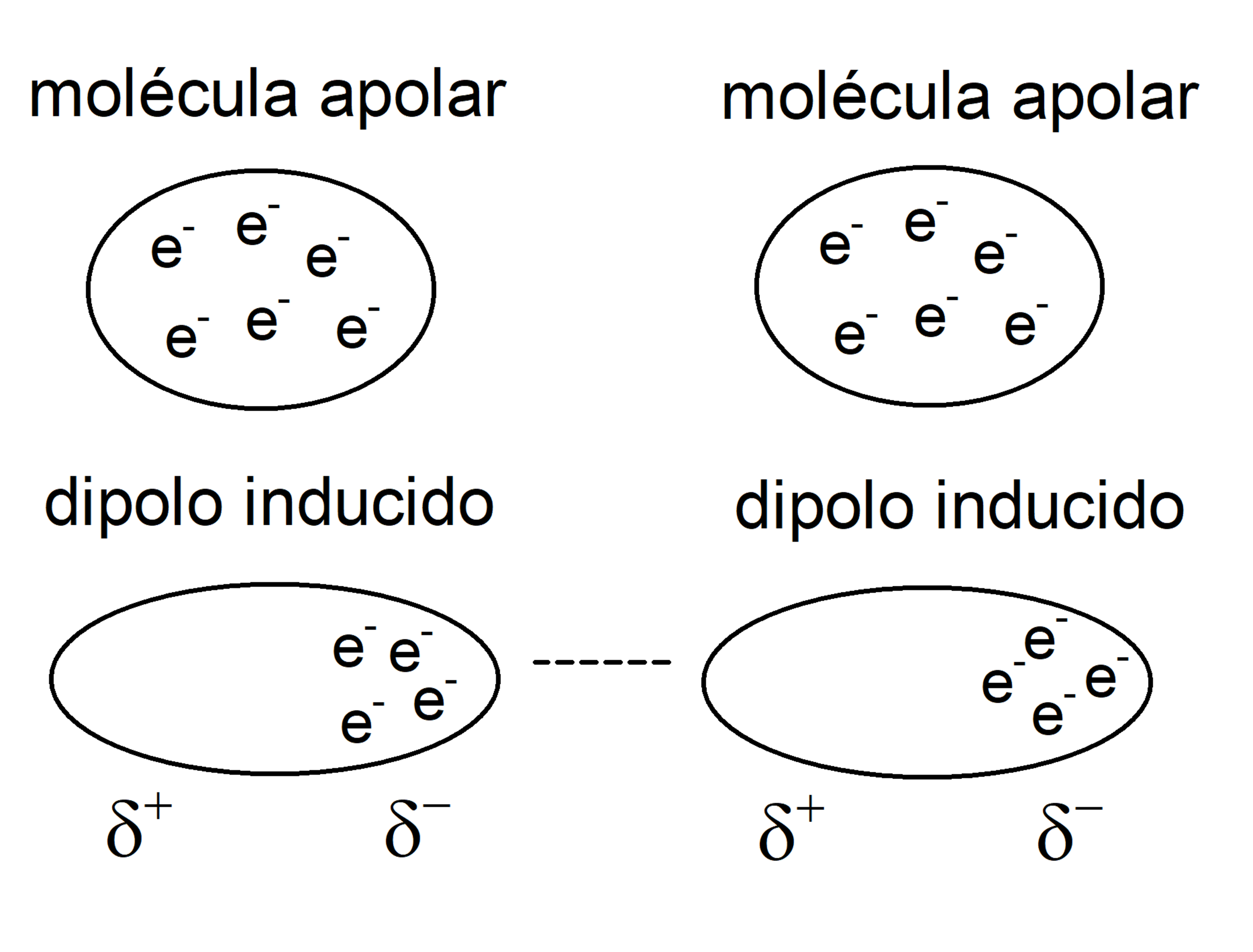
- Dipôle – dipôle induit . Ils se produisent entre une molécule polaire et une molécule non polaire. La densité de charge de la molécule polaire déforme la densité de charge de la molécule non polaire et induit un dipôle.

Liaison hydrogène :
Certains scientifiques appellent ce type de force de liaison par liaison hydrogène, une définition qui est parfois considérée comme erronée. Mais quelle que soit sa définition, c’est l’interaction électrostatique entre un atome électronégatif d’une molécule et un atome d’hydrogène de l’autre.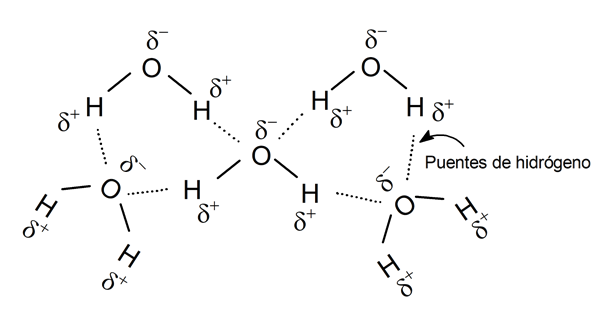
Différences entre les ions et les molécules
Les molécules et les ions diffèrent principalement en ce que ces derniers sont des unités chimiques chargées électriquement, tandis que les molécules sont neutres .
La perte ou le gain d’électrons d’un atome provoque la formation d’ions. Les ions peuvent avoir une charge électrique positive permanente si les atomes perdent des électrons (cations) ou négative s’ils gagnent des électrons (anions). Par exemple, le cation sodium (Na + ) et l’anion chlorure (Cl – ).
En raison de cette charge électrique, la façon dont les ions réagissent est très différente de celle des molécules.
D’autre part, il existe également des ions polyatomiques , qui sont des groupes d’atomes liés par des liaisons covalentes , mais qui, dans leur ensemble, ont une charge électrique. Par exemple, l’ion nitrate (NO 3 – ).
stabilité moléculaire

La stabilité chimique des molécules est liée à l’énergie contenue dans leurs liaisons chimiques et à leur réseau moléculaire.
Plus la molécule a d’énergie, plus elle sera réactive et moins stable. La rupture de liaisons chimiques nécessite généralement de l’énergie et leur formation libère presque toujours de l’énergie .
C’est pourquoi les molécules ont tendance à avoir une plus grande stabilité que leurs atomes séparés . Et c’est aussi la raison pour laquelle les atomes ont tendance à se joindre à d’autres pour former des molécules.
Différences entre atome et molécule
Les molécules sont constituées d’atomes liés entre eux , de sorte que les atomes sont beaucoup plus petits et plus simples que les molécules.
Les molécules plus grosses sont constituées de molécules plus petites et plus simples , qui deviennent des parties ou des « amas ».
Pour cette raison, la plupart des molécules peuvent subir diverses procédures de rupture ( lyse ) de leurs liaisons chimiques, afin d’obtenir des molécules plus simples (si possible) ou des atomes appartenant à certains éléments chimiques.
exemples de molécules
Voici quelques exemples de molécules courantes :
- Hydrogène : H2
- Acide chlorhydrique : HCl
- Dioxyde de carbone : CO2
- Acide sulfurique : H2SO4
- Éthanol : C2H5OH
- Acide phosphorique : H3PO4
- Chloroforme : CHCl3
- Glucose : C6H12O6
- Saccharose : C12H22O11
- Acétone : C3H6O
- Cellulose : C6H10O5
- Ammoniac : NH3
S’ensuit avec : Composés organiques