Nous expliquons ce qu’est l’oxygène, quand il a été découvert et quelles sont ses propriétés. De plus, ses caractéristiques, ses utilisations et plus encore.

Qu’est-ce que l’oxygène ?
L’oxygène (O) est un élément chimique non métallique , normalement gazeux, extrêmement abondant dans notre atmosphère (il représente 20,8 % de son volume actuel) sous sa forme moléculaire (O 2 ) et le troisième plus abondant dans l’ univers (après le hydrogène et hélium). Il est essentiel à la vie telle que nous la connaissons, notamment pour sa capacité à former la molécule d’eau (H 2 O) avec l’hydrogène .
Le nom d’oxygène vient du grec ancien oxys (« acide ») et -gonos (« producteur, générateur »), c’est-à-dire qu’il signifie « producteur d’acides » car à cette époque on supposait à tort que les acides contenaient toujours de l’oxygène dans leur structure chimie.
Il est très réactif, donc on ne le trouve généralement pas dans son état élémentaire (O) , mais en formant des molécules composées de ses propres atomes ou en formant des composés chimiques avec d’autres éléments.
La molécule d’oxygène est généralement diatomique (O 2 ) à température et pression ambiantes ou triatomique (ozone O 3 ) dans des conditions environnementales spécifiques. Par exemple, l’O 3 présent dans la stratosphère se forme lorsque les rayons ultraviolets décomposent l’O 2 , tandis que l’O 3 présent dans la troposphère se forme à la suite de réactions photochimiques entre des composés organiques volatils et des oxydes d’azote.
Comme il a une très grande réactivité , les atomes de cet élément se retrouvent dans de nombreux composés organiques et inorganiques de la planète , dans les différents états d’agrégation de la matière . C’est donc un élément extrêmement courant dans le monde et l’univers connu.
Voir aussi: Liaison chimique
Oxygène sur le tableau périodique
Dans le tableau périodique, l’oxygène se trouve au début du groupe 16 (VIA) , parmi les éléments non métalliques appelés amphigènes.
Il est représenté par la lettre O et dans ce groupe il est suivi par le soufre (S), le sélénium (Se), le tellure (Te), le polonium (Po) et le livermorium (Lv).
L’oxygène a le numéro atomique 8 et est le deuxième élément le plus électronégatif du tableau périodique (le fluor est le plus électronégatif). C’est l’un des éléments qui se trouve à l’état gazeux dans les conditions de pression et de température ambiante.
Quand l’oxygène a-t-il été découvert ?
Bien que nombre de ses propriétés soient connues depuis l’Antiquité grâce à l’étude de l’air , l’oxygène en tant qu’élément a été découvert en 1772 par Carl Wilhelm Scheele . Ce pharmacien suédois a remarqué, en brûlant de l’ oxyde mercurique , qu’un « air de feu » était libéré.
D’autres scientifiques de l’époque, comme le pasteur britannique Joseph Priestley, firent la même découverte dans des expériences similaires et lui donnèrent le nom d' »air déphlogistiqué ».
Plus tard, Antoine de Lavoisier se consacra à l’étude de la combustion et de l’oxydation , et écarta les théories sur le « phlogiston », qui était une substance supposée présente dans tout combustible. Au contraire, il proposa l’existence d’un nouvel élément chimique : l’oxygène.
En 1808, John Dalton a développé sa théorie atomique , où il déclare que tous les éléments chimiques sont monoatomiques et que les composés sont formés en utilisant la plus petite quantité possible de chaque élément. Selon cette théorie, l’eau avait la formule HO (ce qui est une erreur, la bonne formule est H 2 O).
Puis, en 1877, les physiciens Raoul Pictet et Louis Paul Cailletet parviennent à obtenir de l’oxygène liquide , bien que la quantité qu’ils obtiennent ne soit pas suffisante pour l’analyser. En 1891, le chimiste James Dewar a réussi à obtenir une quantité adéquate d’oxygène liquide pour une étude plus approfondie et en 1895, la première méthode a été développée pour le produire avec un intérêt commercial.
Propriétés chimiques de l’oxygène

L’oxygène est un produit chimique hautement réactif , capable de former des composés avec presque tous les éléments connus à l’exception de l’hélium (He) et du néon (Ne). C’est le principal anfígenos (formateurs d’ acides et de bases ) et ses états d’oxydation sont -2 et -1.
C’est un élément qui forme des composés inflammables et qui est très réactif. Au contact des métaux, il forme des oxydes et corrode les surfaces.
- Forme des oxydes avec les métaux alcalino-terreux.

- L’aluminium en poudre brûle violemment en présence d’oxygène.
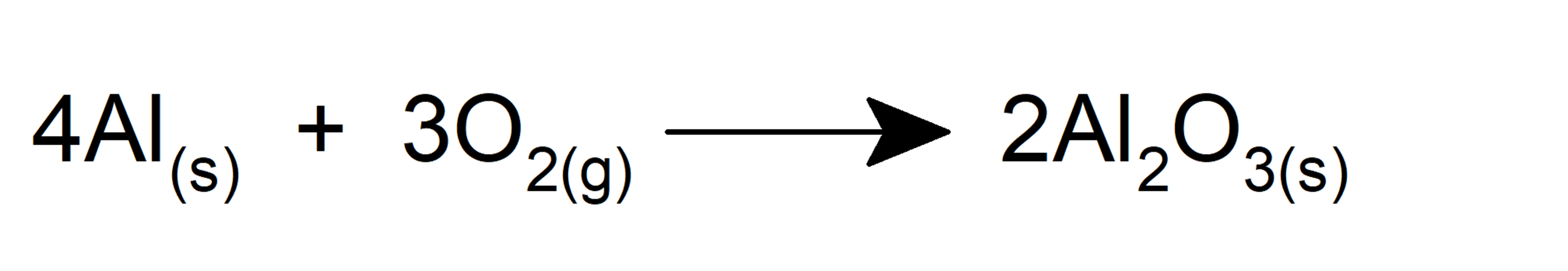
- Il oxyde le fer pour former de l’oxyde de fer (III).
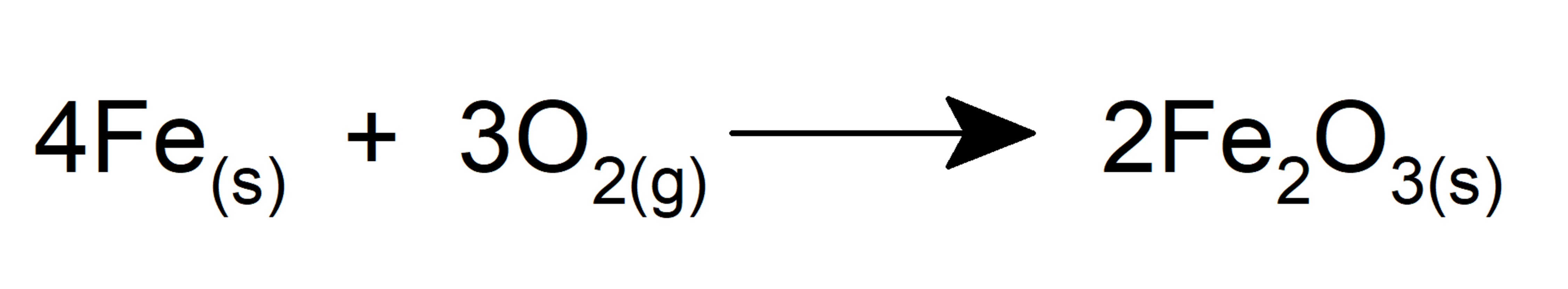
- Il forme des oxydes lorsqu’il réagit avec le carbone .
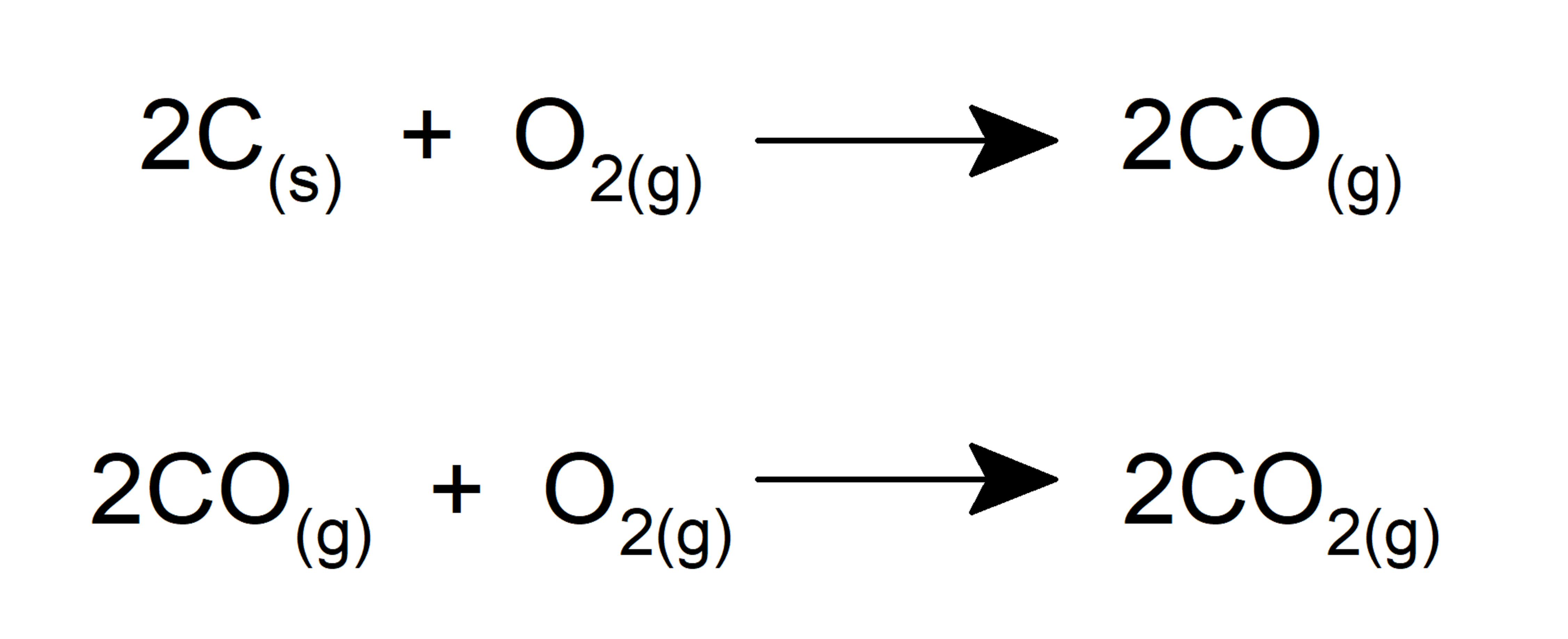
Propriétés physiques de l’oxygène

Dans des conditions normales de pression et de température, l’oxygène se manifeste sous la forme d’un gaz incolore, inodore et insipide . Il est beaucoup plus soluble dans l’eau que l’azote : l’eau douce contient environ 6,04 ml d’oxygène par litre, tandis que l’eau de mer en contient 4,95 ml par litre.
D’autre part, l’oxygène peut se condenser (passer du gaz au liquide) à -182,95 °C et geler à -218,79 °C, devenant respectivement un liquide et un solide avec une légère coloration bleue.
isotopes de l’oxygène
L’oxygène a trois isotopes naturels et stables : 16O , 17O et 18O , dont le premier est le plus abondant (99,762 %) .
On sait qu’il existe 14 isotopes radioactifs de l’oxygène, dont le plus stable est le 15 O.
Importance biologique de l’oxygène
L’oxygène est essentiel dans la vie . Il fait partie des sucres et des acides aminés qui composent les molécules biologiques essentielles : glucides , protéines , lipides , etc. De plus, il fait partie des molécules essentielles au transport de l’énergie dans l’organisme des êtres vivants (ADP et ATP).
D’autre part, l’oxygène est indispensable à la réalisation de la photosynthèse chez les plantes , les algues et certaines bactéries . Pour mener à bien ce processus, ces organismes utilisent le dioxyde de carbone (CO 2 ) de l’air et de la lumière du soleil pour transformer des molécules inorganiques (telles que le CO 2 et l’eau) en glucides, comme le glucose. Enfin, l’oxygène est libéré dans l’ environnement en tant que produit de cette séquence de réactions.
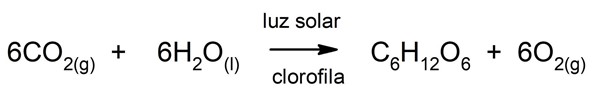
Grâce à ce processus, il y a 2,5 milliards d’années, l’atmosphère a commencé à se remplir de cet élément. De nombreuses formes de vie anaérobie à l’époque ont été anéanties.
Au contraire, les animaux et autres êtres vivants capables de respirer ont besoin d’oxygène atmosphérique pour décomposer les molécules de glucose que nous obtenons des aliments . C’est ainsi que nous obtenons l’énergie dont nous avons besoin pour survivre.
Au cours de ce processus, appelé respiration, les organismes aérobies absorbent l’O 2 de l’air et libèrent du CO 2 comme sous-produit .
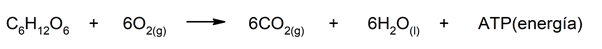
utilisations de l’oxygène
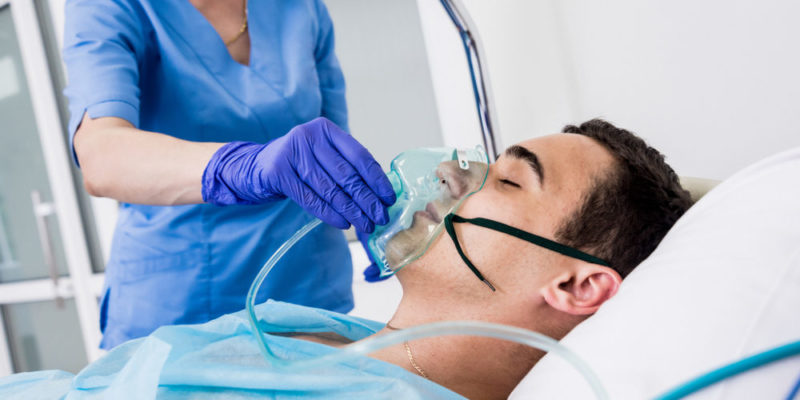
L’oxygène a d’énormes applications dans les industries humaines, telles que :
- Utilisations médicales . L’oxygène est utilisé comme gaz respirable pour maintenir en vie les patients chirurgicaux et comme thérapie (oxygénothérapie) pour les patients souffrant de maladies cardiaques et pulmonaires, etc. Certains isotopes de l’oxygène tels que 15 O ont été utilisés pour la tomographie par positrons.
- Soutien à la vie . Dans les missions spatiales et sous-marines, l’oxygène gazeux à basse pression est utilisé comme gaz respiratoire pour maintenir les niveaux d’habitabilité des combinaisons, des engins spatiaux et des logements.
- Utilisations industrielles . 55% de l’oxygène produit dans le monde dans les laboratoires va à certains alliages de fer , comme l’ acier . Un autre 25% va à l’industrie chimique, pour créer de l’oxyde d’éthylène (C 2 H 4 O), base de la fabrication de nombreuses matières textiles et plastiques . Enfin, l’oxygène est également utilisé pour brûler l’acétylène et fabriquer des chalumeaux capables de couper le métal très rapidement.
- Combustibles et purificateurs . L’oxygène est également utilisé pour oxyder le carburant des fusées, pour le traitement des eaux usées ou comme ozone (O 3 ) pour les purificateurs d’eau.
production industrielle d’oxygène
La production industrielle d’oxygène se fait principalement par deux méthodes :
- Filtration de l’air à l’aide de zéolithe . Cette méthode consiste à faire passer de l’air propre et sans humidité à travers des tamis moléculaires zéolithiques retenant l’azote (N 2 ) et laissant passer un air dont la teneur en oxygène (O 2 ) est comprise entre 90 et 93 %. Cette méthode est utilisée pour obtenir de l’oxygène à petite échelle.
- Électrolyse de l’eau . Cette méthode consiste en la décomposition de la molécule d’eau en hydrogène et oxygène grâce à l’utilisation de l’électricité : l’anode (+) attire les molécules d’oxygène gazeux vers un récipient, et la cathode (-) celles de l’hydrogène.
Composés d’oxygène inorganique

L’oxygène, en raison de sa forte électronégativité, réagit avec d’autres éléments pour former des oxydes . Dans les oxydes, l’oxygène a un état d’oxydation -2, tandis que dans les peroxydes, il a -1.
Le composé inorganique le plus courant de l’oxygène est l’eau (H 2 O), mais il existe de nombreux oxydes dans lesquels un élément métallique, non métallique ou métalloïde est combiné à l’oxygène. Par exemple : le dioxyde de silicium (SiO2), présent dans le sable et le granit ; l’alumine (Al2O3) présente dans la bauxite et le corindon ; oxyde de fer (Fe2O3), dans l’hématite et l’urine ; etc.
composés organiques de l’oxygène
En chimie organique , l’oxygène est un élément commun dans le cadre de macromolécules complexes, telles que les alcools (R-OH), les éthers (ROR), les cétones (R-CO-R) , les aldéhydes (R-CO-H) et les esters (R -COO-R) Pour cette raison, de nombreux solvants organiques ont une forte présence d’oxygène.
Cependant, la plupart des composés organiques contenant de l’oxygène, contrairement aux inorganiques, ne sont pas produits par leur action directe , mais dans le cadre de processus chimiques plus complexes.
Risques liés à son utilisation

L’oxygène gazeux (O2) peut être un agent toxique dans le corps humain lorsqu’il est à une pression supérieure à 50 kPa. C’est le genre de pression à laquelle sont soumis les plongeurs en eau profonde et les plongeurs autonomes. Les symptômes d’empoisonnement à l’oxygène comprennent des convulsions, des lésions oculaires, des spasmes et des lésions neurologiques.
D’autre part, étant si combustible, la manipulation d’oxygène à des concentrations élevées implique des risques d’explosion ou d’incendie , car la molécule est sujette à une combustion rapide.
S’ensuit avec : Métaux alcalins