Nous expliquons ce qu’est une liaison covalente, sa polarité et comment elle est classée. Aussi, quelles sont ses caractéristiques et quelques exemples.
Qu’est-ce qu’une liaison covalente ?
Une liaison covalente est un type de liaison chimique dans laquelle deux atomes se rejoignent en partageant des électrons dans leur couche atomique la plus superficielle ou dans leur dernière orbitale atomique (probabilité de trouver un électron autour du noyau), atteignant ainsi l’octet stable (selon le Gilbert règle de l’octet de Newton Lewis). Les atomes liés partagent une (ou plusieurs) paires d’électrons.
Ce type de liaison diffère de la liaison ionique en ce que les atomes qui la forment ont une différence d’électronégativité inférieure à 1,7, tandis que dans la liaison ionique, ils ont une différence supérieure à 1,7.
Des liaisons covalentes sont formées entre des atomes de non-métaux identiques ou différents et entre un non-métal et l’hydrogène.
Les liaisons covalentes sont différentes des liaisons ioniques, car lors de la formation de liaisons ioniques, il y a un transfert d’électrons d’un atome à un autre, formant des ions de charges opposées qui sont ensuite attirés électrostatiquement. De plus, la liaison ionique se forme entre les atomes d’un métal et d’un non- métal .
Voir aussi: Forces intermoléculaires
règle de l’octet
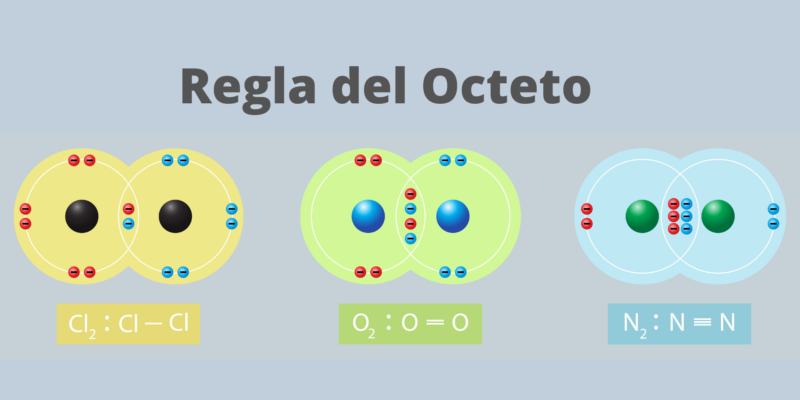
La « règle de l’octet » a été formulée par Gilbert Lewis au début du 20ème siècle , pour décrire la tendance des atomes à se rassembler pour former une enveloppe électronique externe « complète » ou « fermée », selon leur valence (nombre d’électrons qui doit accepter ou abandonner un atome pour compléter sa dernière coquille). Ce principe est celui qui régit les liaisons covalentes.
Ladite couche complète serait composée de huit (8) électrons, donc un atome de valence 6 chercherait une paire de plus et un atome de valence 2 chercherait à en avoir jusqu’à six de plus, puisque dans cette configuration l’atome jouit d’une grande stabilité, similaire à qui présentent les gaz nobles .
Différences avec la liaison ionique (électrovalente)
Alors que la liaison covalente, comme on l’a dit, consiste à partager des paires d’électrons de l’enveloppe externe des atomes joints, les liaisons ioniques consistent à transmettre ou prêter un électron entre un atome et l’autre .
Pour que cela se produise, l’un des deux atomes doit céder un ou plusieurs électrons à l’autre atome. Ainsi, les atomes doivent être d’un élément métallique et d’un élément non métallique. Ainsi, des ions chargés positivement (cations, provenant du métal) et des ions chargés négativement (anions, provenant du non-métal) sont formés, qui sont électrostatiquement attirés pour former la liaison.
Dipôle électrique
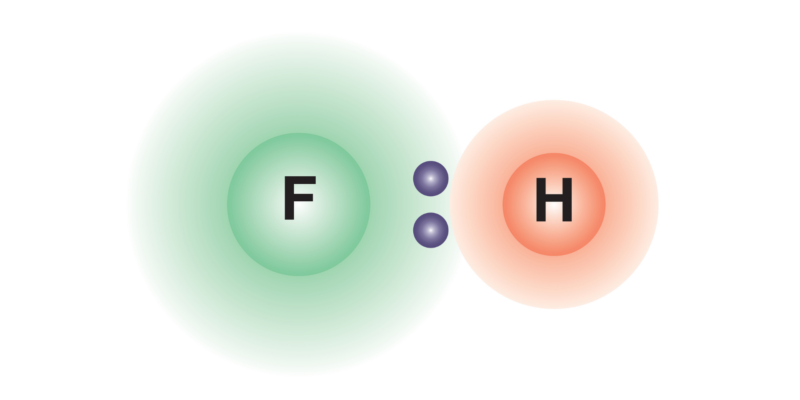
Les liaisons covalentes entre atomes d’ éléments chimiques différents produisent généralement une répartition inégale de la densité de charge électrique sur le composé chimique formé, ce qui génère un dipôle électrique (système de deux charges de signe opposé et d’amplitude égale). Cela se produit parce que l’un des atomes est plus électronégatif que l’autre , il attirera donc plus fortement les électrons de liaison vers lui-même, générant une densité de charge négative sur lui et positive sur l’autre atome, ce qui conduit à la formation du dipôle .
Cela permet aux molécules covalentes de se joindre à des molécules similaires et de construire des structures moléculaires plus complexes.
Dans le cas où la liaison se forme avec des atomes d’un même élément, la répartition des charges sur le composé chimique formé sera la même dans toute sa structure, il ne faut donc pas produire de dipôle électrique.
Polarité
La polarité est une propriété des composés chimiques qui ont une répartition non uniforme (inégale) des charges sur leur structure, elle est donc étroitement liée à la formation de dipôles électriques . Selon la présence ou l’absence de polarité, il est possible de distinguer les liaisons covalentes polaires (qui forment des molécules polaires ) et les liaisons covalentes non polaires (qui forment des molécules apolaires ou apolaires).
- Liaisons covalentes polaires . Ils sont produits entre des atomes d’éléments chimiques différents et qui ont une différence d’électronégativité supérieure à 0,5. Ces liaisons forment le dipôle électromagnétique.
- Liaisons covalentes non polaires ou apolaires . Ils se forment entre des atomes d’un même élément chimique, dont l’électronégativité est la même. Ils se forment également entre des atomes d’éléments chimiques différents, mais qui ont une très faible différence d’électronégativité (inférieure à 0,4). Puisque le nuage d’électrons est également attiré par les deux noyaux, le dipôle ne se forme pas dans la molécule.
Types de liaison covalente
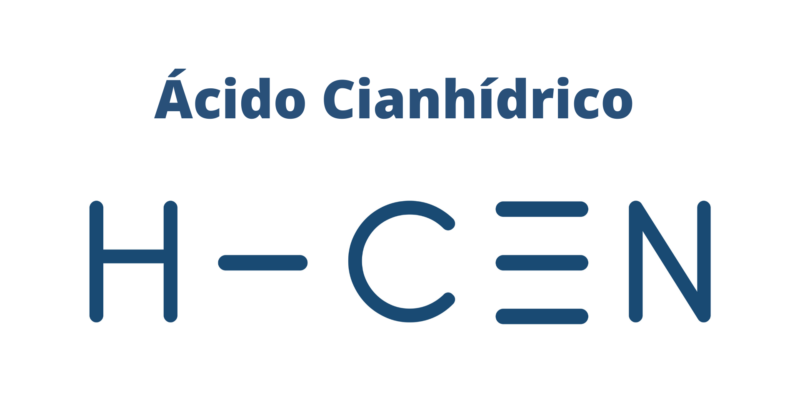
Il existe les types de liaison covalente suivants :
- Plaine . Les atomes partagent une paire d’électrons dans leur coquille la plus externe (un électron de chacun). Par exemple : HH, H-Cl.
- doubler . Les atomes apportent chacun deux électrons, formant une double liaison à quatre électrons. Par exemple : O=O, O=C=O.
- triplé . Les atomes apportent trois électrons pour former trois paires électroniques, soit six électrons au total formant la triple liaison. Par exemple : N≡N.
- Datif . Une liaison covalente dans laquelle l’un des deux atomes apporte deux électrons et l’autre aucun. Par exemple : NH 4 + .
rupture des liaisons covalentes
Lorsque les atomes sont liés par covalence, ils dégagent souvent de l’énergie . Par conséquent, pour rompre ladite liaison, il est nécessaire de fournir cette énergie perdue , qui variera selon le type d’atomes liés et le type de liaison covalente formée. Ainsi, l’énergie de liaison est l’énergie totale qui est libérée lorsqu’une mole de liaisons covalentes est formée et c’est la même qui devrait être appliquée pour rompre cette mole de liaisons.
Par exemple, pour rompre les liaisons covalentes de 1 mol de molécules d’hydrogène (H 2 ) , il faut appliquer 104 kilocalories/Kcal (435 kilojoules/kJ).
Types de substances covalentes
Les substances dont les atomes ont des liaisons covalentes peuvent être de deux types :
- moléculaire . Ils forment des molécules à basse température de fusion et d’ébullition, isolantes thermiquement et électriquement, molles lorsqu’elles sont solides et solubles dans d’autres substances de polarité similaire (polaire en polaire et non polaire en non polaire). Par exemple : l’oxygène (O 2 ).
- réticulaire . Ils forment des réseaux cristallins d’atomes (semblables aux composés ioniques) et ont des températures de fusion et d’ébullition élevées, une dureté et une solidité dans des conditions normales de pression et de température (1atm et 25 °C), une insolubilité et sont des isolants thermiques et électriques. Par exemple : quartz.
valence atomique
La valence est le nombre d’électrons qu’un atome doit abandonner ou accepter pour compléter sa couche la plus externe . C’est une information essentielle lors de l’étude des liaisons covalentes, car elle nous indique combien d’électrons l’atome a besoin pour atteindre la stabilité.
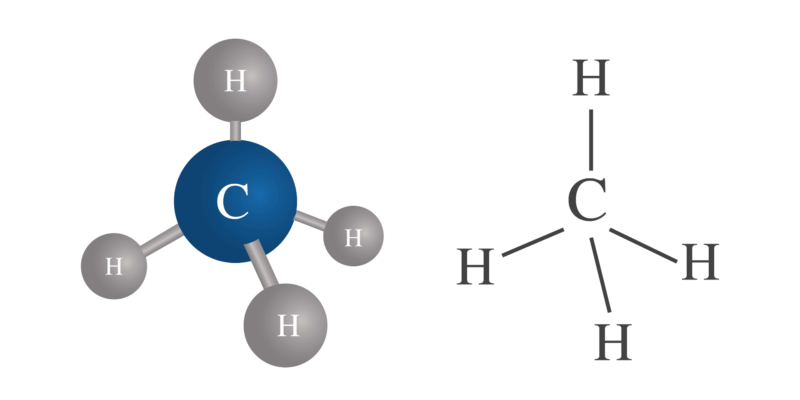
Cette valence peut varier dans un même atome . Par exemple, le carbone (C) a la valence 4, l’hydrogène (H) la valence 1, mais le soufre (S) peut avoir la valence 2, 4 et 6.
Exemples de substances polaires et non polaires
Selon la polarité des liaisons covalentes que présentent leurs molécules, on peut parler de composés polaires comme :
- Méthanol, phénol, acétone, acide propionique.
Et des substances non polaires telles que :
- Éthane, toluène, isobutane, n-Pentane.
Exemples de composés liés par covalence
- Une molécule d’oxygène (O 2 ) : O=O (double liaison)
- Une molécule d’ hydrogène (H 2 ) : HH (liaison simple)
- Une molécule de dioxyde de carbone (CO 2 ) : O=C=O (doubles liaisons)
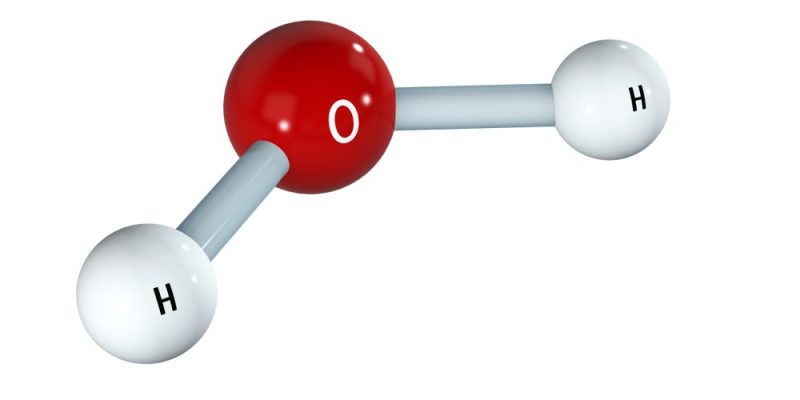
- Une molécule d’eau (H 2 O) : HOH (liaisons simples)
- Une molécule d’ acide chlorhydrique (HCl) : H-Cl (liaisons simples)
- Une molécule d’azote (N 2 ) : N≡N (triple liaison)
- Une molécule d’acide cyanhydrique (HCN) : HC≡N (liaison simple et triple liaison)
Cela peut vous aider : Atome de carbone







