Nous expliquons ce que sont les sels, les propriétés qu’ils présentent et comment ils sont classés. Aussi, quelles sont ses caractéristiques et quelques exemples.

Quels sont les sels ?
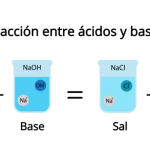
Les composés chimiques résultant d’une liaison ionique entre des particules chimiques chargées positivement (cations) et des particules chargées négativement (anions) sont appelés sels . Ils sont le résultat typique de la réaction chimique entre un acide et une base , également appelée réaction de neutralisation.
Il existe différents types de sels, selon leur composition chimique, leur utilité pour les industries humaines et leur nomenclature. Le plus connu est peut-être le chlorure de sodium (NaCl) , qui est du sel ordinaire ou du sel de table, utilisé en cuisine.
Voir aussi : Halogènes
Propriétés physiques des sels

Les propriétés des sels peuvent être très variées , selon leur composition.
- De manière générale, ce sont des composés cristallins, à structure ionique.
- Leur structure leur confère des points de fusion élevés et des propriétés diélectriques (isolantes) à l’état solide .
- Beaucoup sont solubles dans l’eau et les solutions salines conduisent l’électricité .
- Ils ont généralement des couleurs différentes (du blanc du sel commun au rouge, noir, bleu et mauve, selon leurs composants). Ses saveurs oscillent entre le salé, le sucré, l’acide et l’amer. Ils dégagent peu ou pas d’odeur.
Propriétés chimiques des sels
- Ils réagissent avec les acides et les bases, réaction dans laquelle un gaz , un solide ou de l’eau est obtenu.
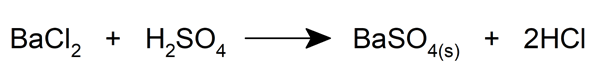
- Ils peuvent réagir entre eux, c’est-à-dire que deux sels peuvent réagir entre eux.
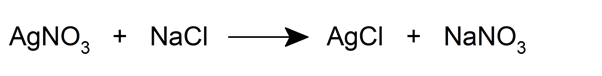
- Ils peuvent se décomposer lorsqu’ils sont chauffés.

Types de sels selon leur composition
Les sels peuvent être classés selon la quantité et le type d’ions (H + et OH – ) qui les composent :
- Sels basiques ou sels hydroxylés . Ils se forment lorsque, dans une réaction de neutralisation, l’hydroxyde est en excès par rapport à l’acide. Les solutions de ces sels ont un pH basique. Par exemple : nitrate de magnésium basique (MgNO 3 OH) et nitrite mercurique basique (HgNO 2 OH).
- Sels acides . Ils se forment lorsque l’hydrogène (pas tous les hydrogènes, mais au moins l’un d’entre eux) dans un acide est partiellement remplacé par un cation métallique. Les solutions de ces sels ont un pH acide. Par exemple : le bicarbonate de lithium (LiHCO 3 ), dans ce cas un hydrogène de l’acide carbonique (H 2 CO 3 ) a été substitué au cation lithium.
- Sels neutres . Ils sont le produit de la neutralisation totale d’un acide et d’une base, et ils sont dépourvus d’ions H + et OH – . Dans ce cas, tous les atomes d’hydrogène d’un acide sont remplacés par un cation métallique. Par exemple : le chlorure de sodium (NaCl), dans ce cas l’hydrogène de l’acide chlorhydrique (HCl) a été remplacé par le cation sodium.
- Sels mélangés . Ils sont composés de deux cations ou de deux anions différents. Par exemple : phosphate de potassium et de calcium (KCaPO 4 ).
- sels hydratés . Ce sont des sels dans la composition cristalline desquels apparaissent des molécules d’eau . Par exemple : sulfate de sodium décahydraté (Na 2 SO 4 * 10H 2 O).
Classification des sels par leur nombre d’éléments

Une autre façon de classer les sels est basée sur le nombre d’ éléments présents dans sa formule, comme suit :
- Sels binaires . Ils ont deux éléments : un métal et un non-métal. Par exemple : le chlorure de sodium (NaCl).
- Sels ternaires . Ils contiennent trois éléments : un métal, un non-métal et de l’oxygène . Par exemple : sélénite de plomb(II) (PbSeO 3 ).
- Sels quaternaires . Ils présentent quatre éléments différents, entre métaux et non-métaux . Par exemple : le bicarbonate de sodium (NaHCO 3 ).
Comment se forment les sels ?
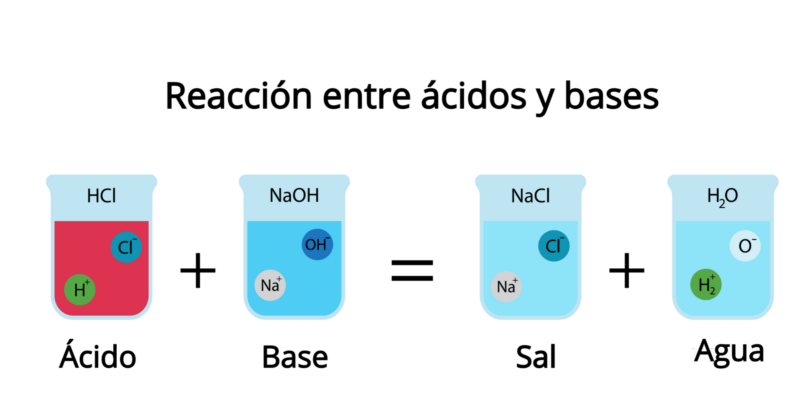
- Les sels se forment lorsque, dans un acide, les atomes d’hydrogène sont remplacés par des atomes de métal ou d’autres réactifs ioniques à partir d’une base ou d’un alcali. Cela se produit généralement dans le processus connu sous le nom de neutralisation.
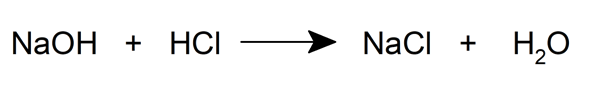
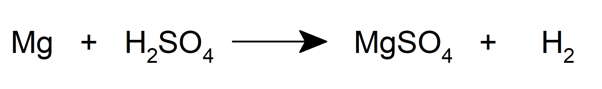
- Ils se forment également lorsqu’un métal et un acide réagissent.
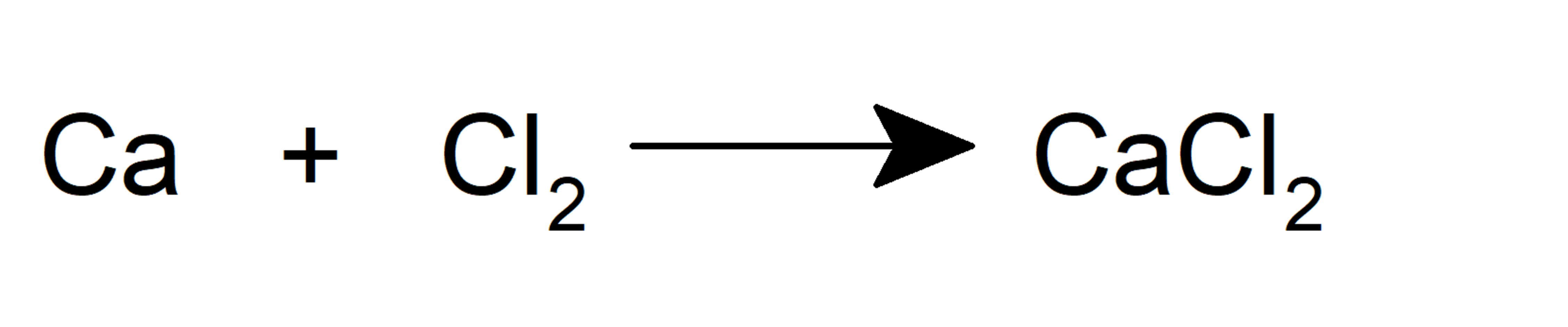
- Ils se forment lorsqu’un métal et un non-métal réagissent.
Nomenclature du sel
Les sels sont nommés comme suit :
- Sels binaires . Ils sont nommés en écrivant le nom du non-métal avec le suffixe -ide, suivi de la préposition « de », suivi du nom du métal. Si le métal a plus d’un nombre d’oxydation, mettez ce nombre en chiffres romains avec des parenthèses à la fin. Par exemple : chlorure de sodium (NaCl), chlorure de fer (II) (FeCl 2 ) et chlorure de fer (III) (FeCl 3 ).
- Sels oxacides .
- Nomenclature des stocks . Ils sont nommés en écrivant le nom de l’ion, suivi de la préposition « de », suivi du nom du métal. Si le métal a plus d’un nombre d’oxydation, mettez ce nombre en chiffres romains avec des parenthèses à la fin. Par exemple : sulfate de magnésium (MgSO 4 ), carbonate de calcium (CaCO 3 ) et nitrate de fer (II) (Fe(NO 3 ) 2 ).
- Nomenclature traditionnelle . Elle part de la terminaison de l’acide d’où provient le sel. Si le nom de l’acide se termine par ‘-oso’, mettez le nom de l’anion du sel avec le suffixe ‘ite’, et s’il se termine par ‘ico’, mettez ‘-ate’.
D’autre part, la terminaison du nom du métal dépendra du nombre de degrés d’oxydation qu’il possède. S’il a deux indices d’oxydation, celui avec le plus petit indice d’oxydation se termine par ‘-oso’ et celui avec le plus haut par ‘-ico’.
Par exemple : dans le sulfate de magnésium (MgSO 4 ), l’ion sulfate (-ate) provient de l’acide sulfurique (H 2 SO 4 ) (-ic). Dans le sulfate ferreux (Fe(SO 4 ) 2 ) le fer a le degré d’oxydation 2+ et dans le sulfate ferrique (Fe(SO 4 )) 3 ) a 3+.
- Sels acides . Ils sont nommés en indiquant le nombre d’hydrogènes non substitués dans la molécule, en utilisant le préfixe correspondant. Par exemple, le sel NaHS est appelé sulfure d’hydrogène de sodium, car l’anion HS – provient du sulfure d’hydrogène (H 2 S). Hydrogénocarbonate de lithium (LiHCO 3 ), dont l’anion provient de l’acide carbonique (H 2 CO 3 ).
- Sels basiques . Ils sont nommés en indiquant le nombre d’hydroxyles suivi de l’anion central et enfin du cation métallique. Par exemple, MgCl(OH) est appelé hydroxychlorure de magnésium ou il peut également être appelé chlorure de magnésium basique.
- sels hydratés Ils sont nommés en indiquant le nom du sel correspondant suivi du préfixe correspondant à la quantité de molécules d’eau, suivi du mot ‘hydraté’. Par exemple : MgSO 4 * 5H 2 O est appelé sulfate de magnésium pentahydraté.
Où sont les sels ?

Les sels peuvent être trouvés dans le cadre de minéraux souterrains et rocheux, tels que l’halite, ou également dissous dans l’eau, comme dans les océans et les mers . Ce sont des composés abondants qui sont nécessaires à la vie organique telle que nous la connaissons, ils ne sont donc pas difficiles à acquérir par l’alimentation .
Importance biologique des sels
Les sels font partie de nombreux composés organiques . De plus, ils occupent une place centrale dans les processus biologiques tels que :
- Contraction musculaire .
- Transmission de l’influx nerveux.
- Synthèse de chlorophylle.
- Transport de l’ oxygène dans l’hémoglobine.
- Fonctionnement enzymatique .
- Génération de structures solides insolubles telles que des os, des coquilles, etc.
A quoi servent les sels ?

Les sels ont différentes utilisations dans les industries humaines. En gastronomie, ils sont utilisés comme ingrédients (comme c’est le cas du sel commun ou du bicarbonate de sodium). Dans l’industrie pharmaceutique, ils sont utilisés comme laxatifs et bases pour les fournitures médicales.
Son utilisation industrielle est très répandue. Par exemple, ils sont à la base des extincteurs et de divers matériaux de construction . Ils peuvent également être des desséchants et des engrais. Certains sels plus spécifiques sont utilisés pour fabriquer des explosifs ou pour l’industrie photographique.
Des sels minéraux

Les sels minéraux sont des composés ioniques, d’origine entièrement inorganique (d’où le nom de « minéral »). Cependant, on peut également les trouver dans l’ organisme des êtres vivants , qui doivent les consommer par le biais de l’alimentation , puisque diverses fonctions de régulation, de métabolisme et d’excitabilité nerveuse s’exercent avec eux.
Ils sont particulièrement abondants sur notre planète , ils font partie des minéraux du sous-sol ou se dissolvent dans les eaux marines. En principe, ils ne se distinguent pas des sels organiques, si ce n’est par le type d’éléments présents dans leur constitution moléculaire.
Exemples de sels
Certains sels couramment utilisés sont les suivants :
- Nitrate de sodium (NaNO 3 ) . Il est utilisé pour le traitement du botulisme (maladie causée par des neurotoxines d’origine bactérienne).
- Nitrite de sodium (NaNO 2 ) . Il est utilisé dans l’industrie alimentaire comme conservateur et aussi comme fixateur de couleur.
- Bicarbonate de lithium (LiHCO 3 ) . Il est utilisé comme agent de capture du CO 2 dans les missions spatiales.
- Sulfure d’hydrogène de sodium (NaHS) . C’est un sel dangereux, délicat à manipuler, très corrosif, combustible et toxique.
- Phosphate dicalcique (CaHPO 4 ) . Connu sous le nom de monohydrogénophosphate de calcium, il est utilisé comme additif dans les aliments et les dentifrices.
Il peut vous servir : Verre