Nous expliquons ce que sont les gaz, comment ils sont classés et les propriétés qu’ils présentent. Aussi, quelles sont ses caractéristiques et exemples.

Que sont les gaz ?
Avec le terme gaz, nous nous référons à l’un des trois principaux états d’agrégation de la matière (avec les liquides et les solides ). Il se caractérise par la dispersion, la fluidité et la faible attraction entre ses particules constitutives.
Les gaz sont la forme de matière la plus volatile dans la nature et sont extrêmement courants dans la vie quotidienne . Ainsi, lorsqu’une substance est à l’état gazeux , on l’appelle généralement un gaz.
Les substances liquides ou solides peuvent être transformées en gaz par différents procédés. Cette transformation implique une modification des propriétés physiques des substances, telles que leur état d’agrégation. Cependant, leurs propriétés chimiques ne changent pas, car les substances continuent d’avoir la même structure chimique, c’est-à-dire que les liaisons chimiques ne se rompent pas ou que de nouvelles substances sont générées.
Les gaz se trouvent partout : de la masse hétérogène de gaz que nous appelons l’ atmosphère et que nous respirons sous forme d’ air , aux gaz qui sont générés à l’intérieur de l’intestin, produit de la digestion et de la décomposition, jusqu’aux gaz inflammables avec lesquels nous alimentons nos cuisines et fours.
Voir aussi: États d’agrégation
histoire des gaz
Le mot gaz a été inventé au XVIIe siècle par le scientifique flamand Jan Baptista van Helmont , du terme latin chaos (« chaos »).
Il a choisi ce nom en raison du degré apparent de désordre que présentent les molécules de gaz . Cet état était également connu sous le nom de « état aériforme » , mais ce terme est tombé en désuétude.
Les premières lois sur le comportement des gaz sont le résultat de leur étude intensive à la fin du même siècle, notamment leurs relations entre pression, température et volume.
Cela a conduit Émile Clapeyron à formuler la loi idéale pour tous les gaz (« Ideal Gas Law ») en 1834.
gaz parfait et gaz réel
Un gaz parfait est un gaz modèle créé par l’ être humain , et qui n’a pas d’interactions entre les particules qui le composent, c’est-à-dire qu’elles n’ont pas d’attraction ou de répulsion entre elles. En revanche, un gaz réel présente ces interactions.
Plus la formule chimique d’un gaz réel est simple et plus sa réactivité est faible, plus il peut ressembler à un gaz idéal. Ainsi, les gaz monoatomiques, par exemple l’hélium (He), sont ceux qui se comportent le plus comme les gaz parfaits.
More in: Gaz parfaits
lois sur les gaz
L’une des lois les plus utilisées pour décrire le comportement des gaz est la loi des gaz parfaits, qui, à son tour, peut être comprise comme la combinaison d’autres lois :
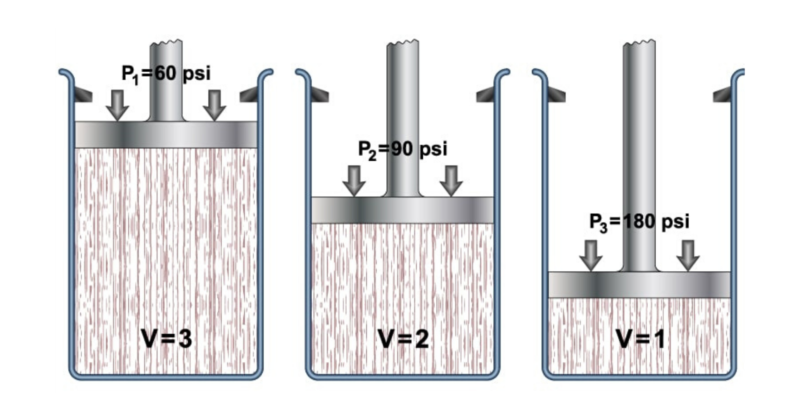
- Loi de Boyle-Mariotte . Il détermine que le volume d’un gaz varie de manière inversement proportionnelle à la pression absolue du récipient où il est contenu, si la température reste constante. Elle s’exprime selon l’équation :
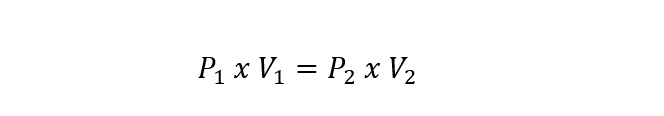
- Loi de Gay-Lussac . Expliquez que la pression d’une masse de gaz dont le volume reste constant est directement proportionnelle à sa température (exprimée en degrés kelvin). Celle-ci est représentée comme suit :
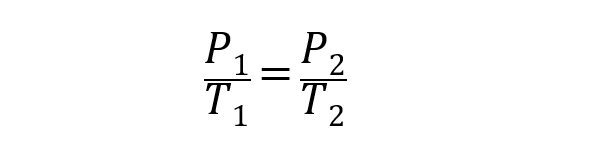
- Loi de Charles . Elle exprime que la température et le volume d’un gaz sont directement proportionnels lorsque la pression est constante. Cette loi est représentée par l’équation suivante :
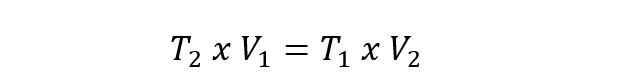
Dans tous les cas précédents V 1 , P 1 et T 1 sont le volume, la pression et la température initiale. Tandis que V 2 , P 2 et T 2 sont le volume final, la pression et la température. - Loi d’Avogadro . Elle exprime que dans des conditions égales de pression et de température, des volumes de composés gazeux différents contiennent le même nombre de particules.
- Loi des gaz parfaits . De la combinaison des lois précédentes, on obtient la loi des gaz parfaits, dont l’équation est représentée comme suit :
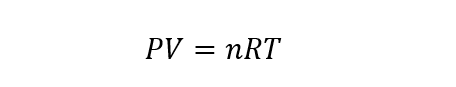
où P , V et T sont la pression, le volume et la température. Alors que n est le nombre de moles de gaz et R est la constante du gaz idéal dont la valeur est de 8,31451 J/molK.
types de gaz
Les gaz peuvent être classés selon leur nature chimique en :
- Combustible ou inflammable . Ceux qui peuvent brûler, c’est-à-dire générer des réactions explosives ou exothermiques en présence d’ oxygène ou d’autres oxydants.
- corrosif . Ceux qui, au contact d’autres substances, les soumettent à d’intenses processus de réduction ou d’oxydation, provoquant des dommages à leur surface ou des blessures dans le cas de la matière organique.
- oxydants _ Ceux qui permettent d’entretenir une flamme ou une réaction inflammable, car ils induisent la combustion d’autres substances.
- toxique . Ceux qui représentent un danger pour la santé en raison des réactions qu’ils introduisent dans l’ organisme des êtres vivants , comme les gaz radioactifs.
- Inerte ou noble . Ceux qui présentent peu ou pas de réactivité, sauf dans certaines situations et conditions.
Propriétés du gaz

Les gaz ont les propriétés suivantes :
- Ils n’ont pas de volume propre . Ils occupent le volume du conteneur dans lequel ils se trouvent.
- Ils n’ont pas de forme propre . Ils assument également celui de votre conteneur.
- Ils peuvent se dilater et se contracter . Comme les solides et les liquides, les gaz se dilatent lorsque leur température augmente et se contractent lorsqu’ils sont refroidis.
- Ils ont une grande fluidité . Les gaz circulent beaucoup plus que les liquides car leurs particules ont moins d’interaction. Ils peuvent facilement se déplacer à travers un trou d’un conteneur à un autre.
- Ils ont une diffusion élevée . Les gaz peuvent facilement se mélanger les uns aux autres en raison du grand mouvement de leurs particules.
- solubilité . Les gaz peuvent être solubles dans l’eau ou d’autres liquides.
- Ils peuvent être compressés . En appliquant une pression sur un gaz, ses particules peuvent être rapprochées, c’est-à-dire que le gaz est comprimé.
changements d’états des gaz

- sublimation . Il s’agit d’un processus physique de changement de phase, qui permet de transformer directement un solide en gaz, sans passer au préalable par une phase liquide. Ce processus est peu courant et implique généralement des conditions de pression et de température spécifiques. On peut l’observer dans la neige carbonique (ou glace) à température ambiante : le bloc solide dégage une légère vapeur qui est la substance retrouvant son état gazeux d’origine.
- bouillant _ C’est le processus par lequel un liquide se transforme en gaz. Il se produit lorsque toute la masse du liquide est chauffée à une température égale à son point d’ébullition.
- évaporation _ Il s’agit d’un processus de changement de phase extrêmement courant, qui conduit un liquide à se transformer en gaz lorsque la température du liquide augmente. Cela se fait lentement et progressivement. Nous le mettons en pratique, par exemple, sous la douche lorsque l’eau très chaude se transforme en vapeur qui peut être vue comme un nuage blanchâtre.
- condensation . C’est le processus inverse de l’évaporation, c’est-à-dire un processus de changement de phase qui conduit de l’état gazeux à l’état liquide, en raison de la perte d’énergie thermique. Cette énergie perdue fait vibrer les particules de gaz plus lentement, leur permettant de se rapprocher et d’interagir plus étroitement, comme cela se produit sur du verre froid un jour de pluie, ou sur des plantes et d’autres surfaces couvertes de rosée.

- Sublimation inversée . C’est le chemin inverse de la sublimation, c’est-à-dire le passage de l’état gazeux à l’état solide sans passer au préalable par un moment de liquidité. Ce processus nécessite des conditions de pression et de température très spécifiques.
Plasma

L’état plasmatique de la matière est considéré comme un quatrième état d’agrégation , mais il présente d’énormes similitudes avec l’état gazeux, puisqu’il s’agit essentiellement d’un gaz ionisé, c’est-à-dire un gaz dont les particules ont perdu des électrons et ont acquis une certaine charge électromagnétique. . Il existe des plasmas froids, comme celui utilisé dans les lampes « à lave », ou des plasmas chauds, comme le feu qui entoure le Soleil.
Exemples de gaz

Voici quelques exemples de gaz :
- Hydrogène ( H2 ) . C’est le gaz diatomique le plus répandu danstout l’ univers .
- Hélium (He) . Insipide, incolore et inerte, c’est le moins soluble dans l’eau de tous les gaz.
- Méthane (CH 4 ) . C’est un hydrocarbure gazeux avec une odeur désagréable qui est obtenu comme produit de la décomposition de la matière organique.
- air . C’est le mélange hétérogène d’hydrogène, d’azote , d’oxygène, d’argon et d’autres gaz que respirent les êtres vivants.
Continuer avec : Fluides