Nous expliquons ce que sont les liquides et les changements d’état qu’ils présentent. Aussi, quelles sont ses caractéristiques générales et des exemples.

Que sont les liquides ?
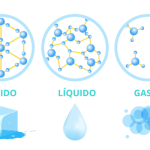
Les liquides sont des substances qui ont un état d’agrégation spécifique dans lequel leurs particules sont suffisamment proches les unes des autres pour maintenir une cohésion minimale (pas autant que les solides , mais beaucoup plus que les gaz ) et suffisamment lâches pour permettre en même temps la fluidité.
Cet état de la matière est généralement considéré quelque part entre les choses solides et gazeuses , et est généralement le résultat de l’application d’ énergie sous forme de chaleur à des choses solides (fusion) ou de la soustraction d’énergie à des choses gazeuses (condensation). . Une autre voie possible pour cela est la variation des conditions de pression. Dans tous les cas, les particules d’un liquide sont à mi-chemin entre la rigidité du solide et la dispersion du gazeux.
Les liquides sont difficiles à comprimer et manquent d’une certaine forme , en même temps qu’ils présentent des propriétés uniques comme la tension superficielle (énergie qui doit être appliquée pour augmenter sa surface). De nombreuses substances sont liquides à l’état naturel (comme l’ eau ), tandis que d’autres ne peuvent l’être que dans des conditions particulières de température et de pression.
Voir aussi : Azote
Caractéristiques du liquide

- forme . Les liquides n’ont pas de forme définie, ils acquièrent donc celle que leur contenant leur imprime. L’eau à l’intérieur d’un verre aura la forme du verre.
- fluidité . La fluidité est l’une des principales caractéristiques des liquides et des gaz, qui détermine leur capacité à quitter un récipient au profit d’un autre par des conduits étroits ou de manière variable, car les particules des substances dans ces états d’agrégation manquent de mémoire de forme, c’est-à-dire , ils n’ont pas une certaine forme, comme les solides.
- viscosité . La viscosité est appelée la résistance à l’écoulement exercée par les forces internes d’un liquide, qui ralentit plus ou moins sa déformation lorsqu’il est vidé de son récipient ou mis en route. Les liquides les plus visqueux (comme le pétrole , le brai, etc.) s’écoulent lentement car leurs particules se collent davantage les unes aux autres lorsqu’elles se frottent les unes contre les autres ; tandis que les liquides à faible viscosité (comme l’eau) s’écoulent beaucoup plus rapidement.
- Adhérence . Les liquides ont une capacité intrinsèque à adhérer à d’autres substances et surfaces, ce qui peut être mis en évidence par les gouttelettes qui restent sur les objets aspergés d’eau ou sur les objets immergés dans un liquide. Les choses se mouillent à cause de ce phénomène particulier des liquides.
- tension superficielle . La tension superficielle est une propriété des particules liquides qui empêche leur surface d’augmenter. Un liquide est capable de résister à la pénétration d’objets jusqu’à une certaine marge, fonctionnant comme une couche élastique. Pour cette raison, certains insectes peuvent « marcher » à la surface de l’eau ou des feuilles mortes peuvent y rester sans couler.
- capillarité _ Cette propriété des liquides dépend directement de leur tension superficielle et leur permet de monter ou de descendre à travers un tube mince qui est immergé dans un récipient rempli de liquide. Ceci est dû au déplacement par volume du liquide, qui résiste à la pénétration du tube et se déplace à l’intérieur de celui-ci. Un exemple clair se produit lorsque nous insérons une paille (paille, paille, paille, etc.) dans un verre d’eau et observons le liquide s’écouler à l’intérieur à des niveaux encore plus élevés que ceux de l’eau dans le verre.
- densité . La densité est la masse par unité de volume du liquide. La densité des liquides est bien inférieure à celle des solides, par exemple, qui résistent à la déformation et présentent une fragilité ; les liquides, en revanche, peuvent se « casser » en particules toujours égales du même liquide.
Changements d’état
du liquide au gaz

- évaporation _ Lorsque de l’énergie thermique est appliquée à un liquide (comme lors du chauffage de l’eau), ses particules sont obligées de se déplacer plus rapidement et d’élargir l’espace entre elles, devenant lentement un gaz. Ce processus se produit lentement et progressivement et la température ne doit pas nécessairement être supérieure à son point d’ébullition.
- bouillant _ Lorsqu’un liquide est chauffé jusqu’à ce que sa température soit supérieure à son point d’ébullition (comme l’eau bouillante), ses particules se déplacent beaucoup plus rapidement et entrent dans la phase gazeuse.
du liquide au solide
- solidification . Lorsqu’une pression est appliquée à un liquide, elle ralentit ou arrête le mouvement de ses particules, ce qui augmente les interactions entre elles, les forçant à former des structures fixes (telles que des cristaux) qui forment un solide.
- Gel _ Lorsqu’un liquide est refroidi en extrayant de l’énergie thermique (comme lors de la congélation de l’eau) jusqu’à ce que sa température soit inférieure à son point de congélation, le mouvement entre ses particules est réduit, augmentant la formation de structures plus rigides et passant ainsi à la phase solide.
du solide au liquide
- Fusionner . La chaleur est introduite dans un objet solide pour permettre à ses particules de surmonter la structure rigide de l’ensemble et de se déplacer plus rapidement, élargissant l’espace qui les sépare et s’écoulant vers la liquidité. Si ce liquide est ensuite refroidi, le processus inverse se produira.
gaz à liquide

- condensation . Elle se produit lorsque des particules de gaz entrent en contact avec une surface froide (ou plus froide que le gaz), ce qui provoque l’apparition de gouttelettes de liquide sur la surface, preuve que le gaz est devenu liquide.
- liquéfaction _ Un autre processus pour convertir les gaz en liquides, mais qui n’utilise pas la température mais la pression pour ce faire : la pression à laquelle le gaz est soumis est augmentée jusqu’à ce qu’il soit énormément comprimé, forçant ses particules à se rapprocher plus qu’elles ne le sont normalement et devenant ainsi dans liquide tant que les conditions de pression sont maintenues.
exemples de liquides

Exemples de liquides. Les liquides les plus abondants dans la nature sont l’eau (H 2 O), le pétrole, le magma terrestre ou la lave (très visqueuse), le sang des animaux supérieurs et la sève des arbres .
Continuer avec : Fluides