Nous expliquons ce qu’est l’eau et comment est sa structure. Aussi, quelles sont ses différentes utilisations et les principales caractéristiques de cette substance.

Qu’est-ce que l’eau ?
L’eau est une substance fondamentale pour la vie et le solvant universel . Nos tissus et ceux de la quasi-totalité des êtres vivants en ont une composante majeure.
On estime qu’il y a environ 1 386 millions de km 3 d’eau sur Terre , mais seulement 2,5 % de ce total (environ 35 millions de km 3 ) correspondent à de l’eau qui peut être rendue potable et consommée sans plus de risques.
De cette petite partie, environ les deux tiers se trouvent formant les grandes masses de glace des calottes polaires , de sorte que les réserves d’eau douce disponibles pour satisfaire les besoins de la population sont aujourd’hui très rares, et se limitent aux eaux douces de surface. ( rivières et lacs ) et aux aquifères souterrains.
Voir aussi : Eau potable
structure de l’eau

La molécule d’eau constitue un dipôle (système formé de deux charges de signe opposé mais de même grandeur) . La molécule d’eau est composée de deux atomes d’hydrogène et d’un atome d’oxygène et prend un caractère polaire. Cela signifie qu’il a une région avec une légère densité de charge négative (celle de l’oxygène ) et une autre zone qui assume une charge positive différentielle (celle des hydrogènes ). Les propriétés biochimiques les plus remarquables de cette molécule sont précisément liées à cette propriété.
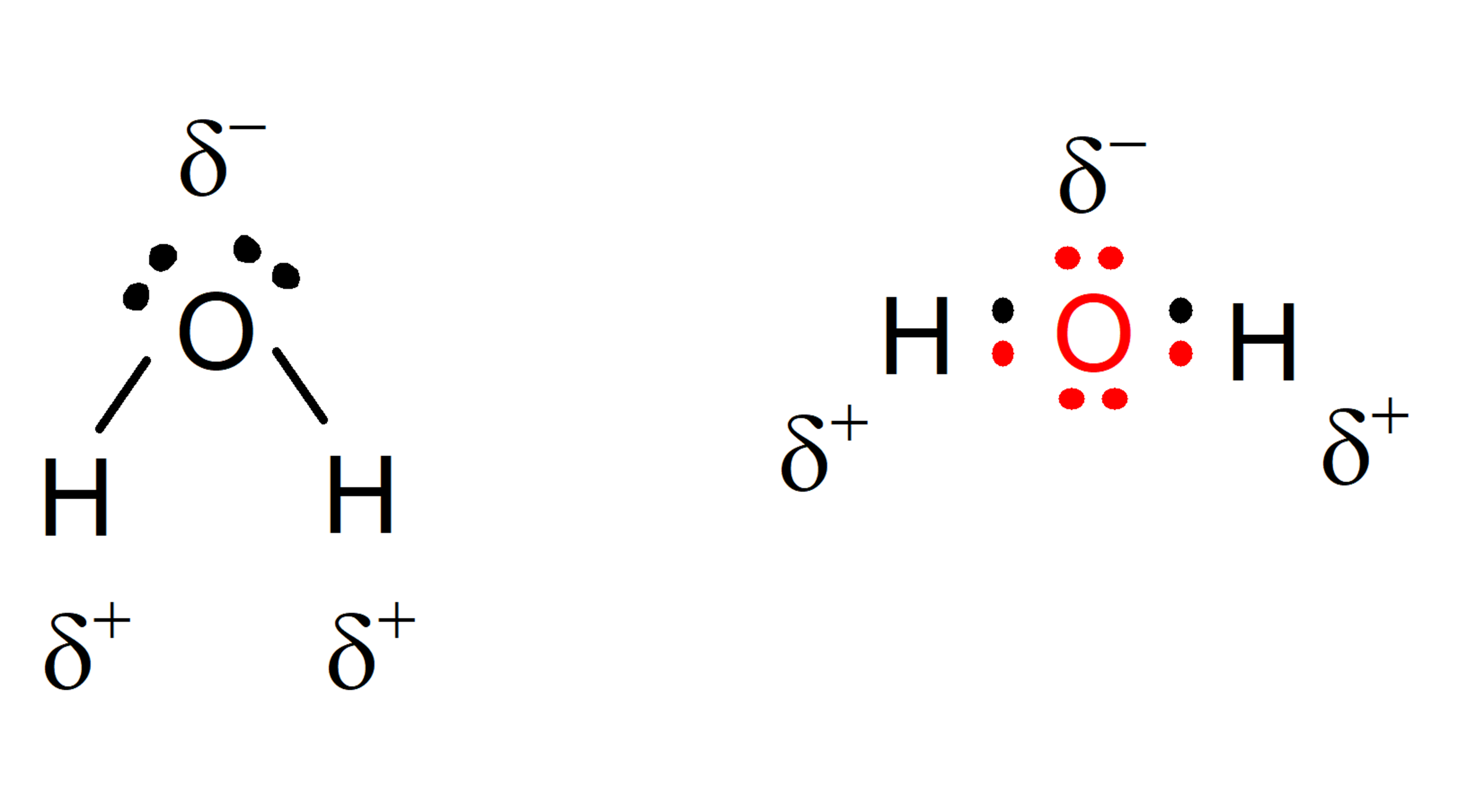
Caractéristiques chimiques de l’eau
- Il a une force de cohésion élevée . L’eau se caractérise par la force de cohésion élevée entre ses molécules, due à la formation de liaisons hydrogène. La présence de charges positives et négatives partielles dans la même molécule les fait se comporter comme des aimants (les parties avec une charge positive partielle attirent les parties avec une charge négative partielle). Ainsi, une molécule d’eau peut joindre 4 autres molécules d’eau par ce qu’on appelle des « liaisons hydrogène », qui ne sont pas des liaisons chimiques mais des interactions électrostatiques.
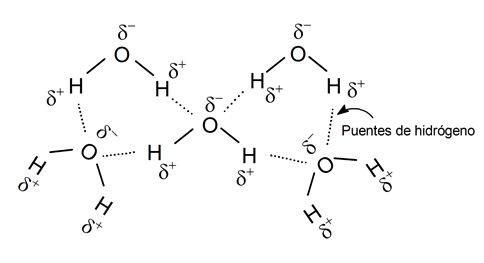
- Il est incompressible . Il n’est pas possible de réduire le volume d’eau en appliquant une pression car les molécules d’eau restent interconnectées, en gardant leurs distances intermoléculaires fixes.
- Sa tension superficielle est élevée . La surface de l’eau oppose une résistance si l’on essaie de l’augmenter ou de la briser. Cela a une implication pratique très importante : l’eau permet la suspension et l’entraînement des micro -organismes , des particules grossières et des molécules insolubles.
- Il a de la capillarité . En raison de sa tendance à la cohésion et à l’adhérence aux surfaces, l’eau peut remonter à travers des tubes de très petit diamètre appelés « capillaires ». Ce phénomène explique en partie pourquoi l’eau qu’un arbre boit du sol peut atteindre sa couronne, ou pourquoi un tuyau qui traverse le sol d’une maison peut provoquer de l’humidité sur un mur qui le surplombe.
- Il a une action dissolvante . En raison de sa nature bipolaire, l’eau est un excellent solvant pour les substances polaires, telles que les sels , les acides , les bases .
- Il a une chaleur spécifique élevée . Cette propriété nécessite beaucoup d’énergie pour élever la température d’une masse d’eau, certainement plus qu’il n’en faut pour élever la température de l’ air . Cela explique sa capacité à réguler le climat : dans les zones côtières les nuits sont plus fraîches car le soleil n’a pas réussi à chauffer à la fois l’eau et l’air. En pratique, l’eau est le liquide de refroidissement le moins cher pour n’importe quel appareil .

Quelques réactions chimiques de l’eau
- Réagit avec les oxydes acides . Les anhydrides ou oxydes d’acide réagissent avec l’eau pour former des acides oxoacides. C’est ce qui se passe, par exemple, lorsque l’eau réagit avec le dioxyde de carbone (CO 2 ) ou le dioxyde d’azote (NO 2 ), ce qui génère respectivement de l’acide carbonique (H 2 CO 3 ) ou de l’acide nitrique (HNO 3 ).
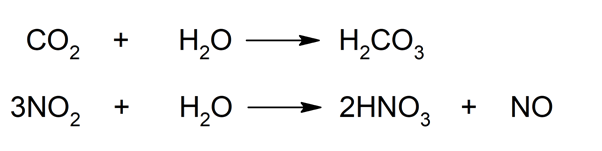
- Peut réagir avec les oxydes basiques . Lorsque l’eau réagit avec des oxydes basiques, c’est-à-dire des oxydes métalliques (tels que le calcium (Ca) ou le magnésium (Mg)), elle génère les hydroxydes correspondants. Lorsqu’il réagit avec des non- métaux , tels que les halogènes sous leur forme moléculaire (diatomique), il en résulte des hydracides, par exemple l’acide chlorhydrique (HCl (aq) ).
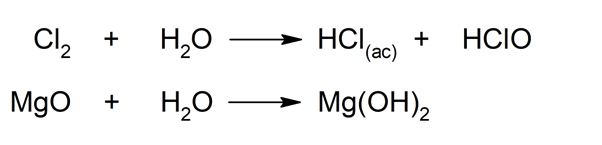
- Il peut produire l’hydratation des sels . De nombreux sels sont vendus à l’état hydraté (par exemple, le sulfate ferreux hydraté avec sept molécules d’eau, ou heptahydraté (FeSO 4 *7H 2 O)), car ils sont ainsi plus solubles et donc plus faciles à utiliser. Cependant, il faut également tenir compte du fait que l’hydratation d’un sel peut être un phénomène indésirable, mais qu’il se produit en tant que produit de son hydrophilie élevée. Ces substances qui ont tendance à piéger l’eau sont dites « hygroscopiques » et peuvent être utilisées comme agents déshydratants ou asséchants. Le cas le plus connu à cet égard est celui du gel de silice.

Il peut vous aider : Hydrocarbures







