Nous expliquons ce qu’est l’atome et comment s’est déroulée l’histoire de sa découverte. Aussi, quelles sont ses principales caractéristiques.

Qu’est-ce que l’atome ?
L’atome est la plus petite particule en laquelle la matière peut être divisée .
Il est important de préciser que la définition d’un atome utilise souvent le terme « particule indivisible » pour désigner la plus petite particule qui conserve encore les propriétés de l’élément chimique auquel elle appartient, mais l’atome est composé de particules encore plus petites ( protons, neutrons, etc.), électrons), mais n’ont pas les propriétés de l’élément chimique.
Les premières notions d’atome sont apparues au début du XIXe siècle , avec les travaux de Dalton, qui a formulé la première théorie atomique et décrit pour la première fois l’existence de minuscules particules sphériques indivisibles qui composent toute la matière et sont égales les uns aux autres dans chaque élément chimique.
Tout au long de ce siècle et au début du siècle suivant, le concept a été affiné par des scientifiques tels que Thomson et Rutherford, jusqu’à atteindre la formulation du modèle atomique de Böhr , proposé par Niels Böhr et selon lequel les électrons tournent autour du noyau à bien -niveaux d’énergie définis.
Voir aussi: modèle atomique de Dalton
caractéristiques de l’atome

- C’est une très petite particule . L’atome est la plus petite particule qui conserve les propriétés de l’élément chimique auquel il appartient. C’est la plus petite unité dans laquelle la matière peut être divisée ; En fait, en grec, le mot atome signifie « indivisible », bien que ce terme ne soit pas tout à fait correct, puisque l’atome est composé de protons, de neutrons et d’électrons.
- C’est une particule infiniment légère . La masse approximative des protons et des neutrons est respectivement de 1,6726 x 10 -27 kg et 1,6749 x 10 -27 kg ; celle des électrons est encore plus petite : 9,1 x 10 -31 Cela rend les atomes extrêmement légers.
- Il forme des molécules . Les atomes sont regroupés pour former des molécules . Chaque type de molécule est la combinaison d’un certain nombre d’atomes liés entre eux de manière spécifique, et une molécule peut contenir des atomes d’éléments chimiques différents ou du même élément.
- C’est immuable . Chaque atome conserve ses caractéristiques structurelles, au-delà du fait qu’ils font partie de molécules différentes. Au cours des réactions chimiques, les atomes ne sont ni créés ni détruits, mais disposés de manière différente créant des liaisons entre un atome et un autre.
- Il a un nombre fixe de protons . Ce qui distingue les éléments chimiques les uns des autres (parmi de nombreuses autres caractéristiques) est le nombre de protons que leurs atomes ont dans le noyau. Le nombre de protons est représenté par la lettre Z et s’appelle le « numéro atomique ». Le nombre de protons correspond au nombre d’électrons dans un atome électriquement neutre. Le numéro atomique apparaît généralement sur le tableau périodique des éléments, situé au-dessus du symbole chimique, à gauche.
- Tend à l’instabilité . La tendance normale de la grande majorité des atomes est de s’unir à d’autres atomes (du même type ou de types différents) pour former des groupements stables (c’est-à-dire des composés chimiques) car cela conduit à une situation d’ énergie minimale et de stabilité maximale. . En formant des liaisons chimiques , ils gagnent, perdent ou partagent des électrons. Ces jonctions contiennent de l’énergie qui est finalement libérée sous forme de chaleur ou de lumière .
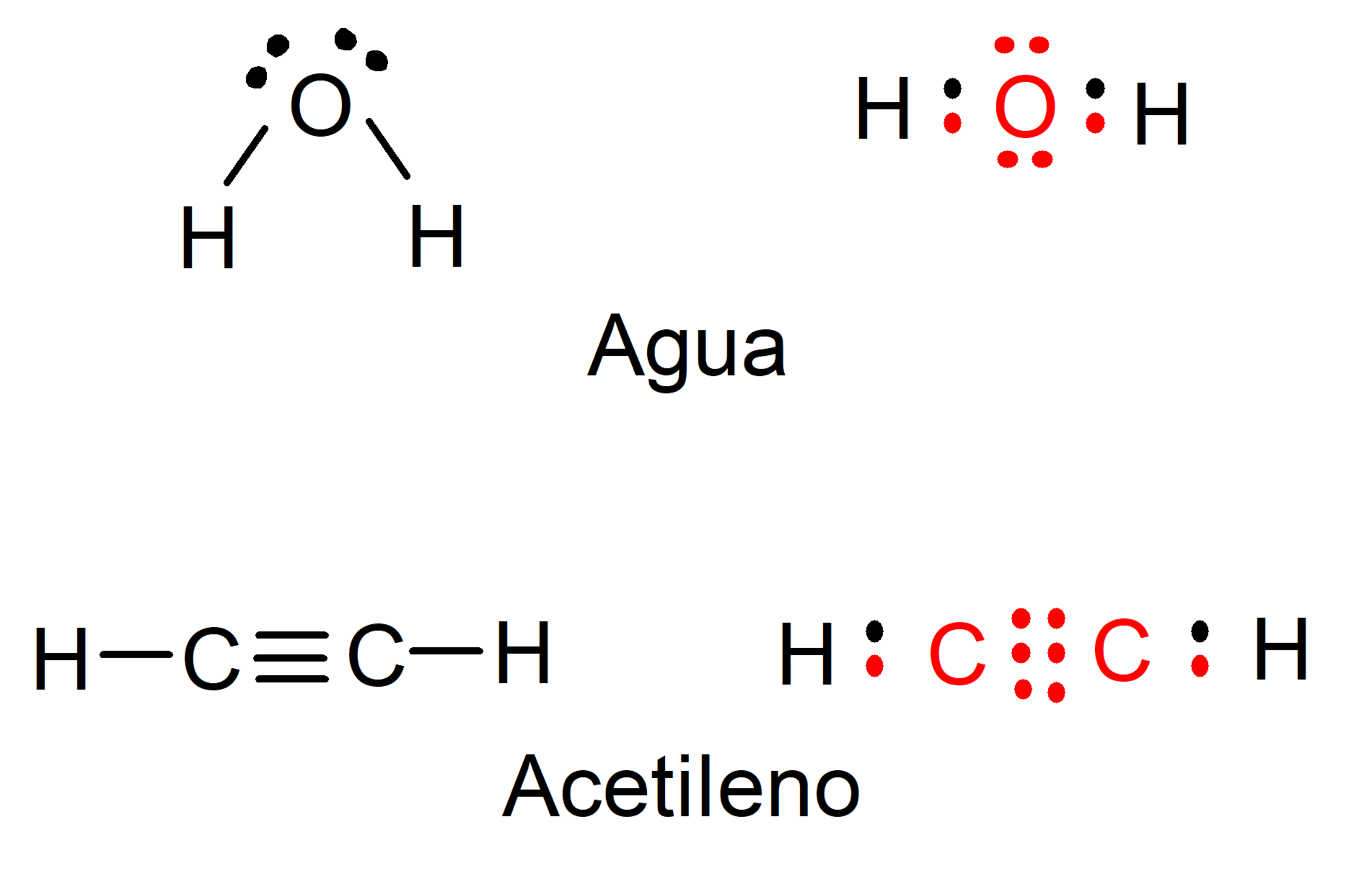
- Il satisfait la règle de l’octet . Ce qui justifie la réactivité et la formation de liaisons, c’est que les atomes respectent la règle de l’octet de Lewis, qui indique que les liaisons répondent au besoin d’acquérir la configuration électronique qui caractérise les gaz nobles ou « inertes », à huit électrons situés dans leur dernier niveau d’énergie. Par exemple : la formation des molécules d’ eau et d’acétylène peut être représentée dans le schéma suivant, où les électrons du carbone et de l’oxygène sont représentés en rouge, tandis que ceux de l’hydrogène sont représentés en noir.
structure de l’atome

L’atome est composé d’un noyau central et d’un nuage d’électrons autour de ce noyau . Le noyau contient des particules chargées positivement appelées protons et également des particules non chargées appelées neutrons. Le nuage d’électrons chargés négativement est attiré par les protons du noyau par une force électromagnétique. À leur tour, les électrons sont caractérisés par des orbitales atomiques, qui sont des fonctions mathématiques qui représentent la probabilité de trouver un électron dans une région de l’espace autour du noyau.
Cela peut vous intéresser: Atome de carbone
masse de l’atome
La masse d’un atome est donnée principalement par la somme des protons et des neutrons de son noyau (puisque la masse des électrons est infiniment petite et donc négligeable). Ce paramètre est appelé le nombre de masse et est représenté par la lettre A.
Bien que le nombre de protons soit identique pour tous les atomes d’un élément chimique donné , le nombre de neutrons peut varier pour certains de ces éléments. Cela se produit, par exemple, avec le carbone ou l’azote , qui sont des éléments qui ont plusieurs isotopes, comme le soi-disant carbone -14 ou azote -15.
Les nombres de masse (somme des protons et des neutrons) de ces deux isotopes sont respectivement de 14 et 15 . Autrement dit, le carbone -14 a 6 protons et 8 neutrons, tandis que l’azote -15 a 7 protons et 8 neutrons.
réactivité chimique

Bien que les protons et les neutrons soient importants en termes de masse et de réactions nucléaires, ce sont les électrons (en particulier ceux du dernier niveau d’énergie du nuage d’électrons) qui sont responsables de la réactivité chimique des atomes.
Ce sont les électrons qui, à terme, vont permettre de produire et de décomposer une infinité de composés chimiques à tout moment. Autrement dit, les électrons sont les particules subatomiques qui forment les liaisons chimiques entre les atomes pour former les divers composés chimiques.
Cela peut vous aider : Forces intermoléculaires