Nous expliquons ce qu’est le modèle atomique de Bohr, son origine et ses principales caractéristiques. En outre, les principaux apports de ce modèle.

Qu’est-ce que le modèle atomique de Bohr ?
Niels Bohr était un physicien danois qui proposa en 1913 un nouveau modèle pour expliquer la structure de l’atome et son comportement à travers la stabilité des électrons . Pour cette contribution décisive à la connaissance , il reçoit le prix Nobel de physique en 1922.
Le modèle proposé par Bohr a fonctionné pour comprendre le fonctionnement de certains types d’ atomes , comme l’ hydrogène , mais pas pour d’autres avec une structure plus complexe. Cependant, son modèle a ouvert les portes pour établir les théories suivantes et a été à la base du modèle atomique moderne ou actuel.
Cela peut vous aider : le modèle atomique de Dalton
Origine du modèle atomique de Bohr
À l’époque de la Grèce antique , on pensait que la matière était composée de principes ou d’éléments indivisibles , c’est-à-dire qu’ils ne pouvaient pas être divisés en parties encore plus petites (comme l’ eau ou l’ air ).
Cependant, les travaux du chimiste John Dalton vers la fin de l’ ère moderne ont fourni les premières approches scientifiques qui ont jeté les bases de la stoechiométrie chimique. En 1803, il expose sa théorie atomique selon laquelle la matière est composée d’atomes de structures différentes.
En 1897, Joseph Thomson a découvert l’électron comme faisant partie de l’atome et en 1911, Ernest Rutherford a développé une théorie sur la structure interne de l’atome . C’est Niels Bohr qui a compris et décrit l’organisation de ces particules appelées électrons et leur distribution sur des orbites spécifiques autour du noyau de l’atome.
Caractéristiques du modèle atomique de Bohr
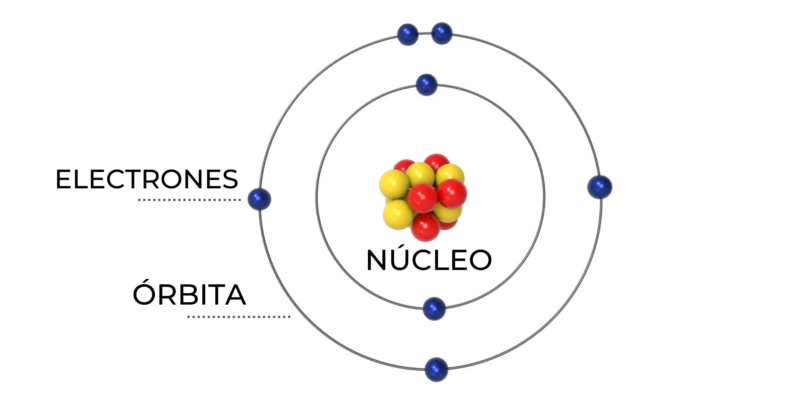
Le modèle atomique de Bohr, qui était à la base du modèle atomique actuel, expliquait la stabilité de la matière et la conformation des liaisons chimiques . L’observation de la représentation graphique du modèle de Bohr permettra de mieux comprendre les caractéristiques suivantes :
- Les électrons qui entourent le noyau d’un atome peuvent être internes ou externes. Les deux types d’électrons sont sur des orbites circulaires autour du noyau, mais les électrons ne peuvent pas être sur toutes les orbites, seulement celles autorisées.
- Les électrons sont à des niveaux d’énergie définis et à des distances fixes. L’orbite la plus proche du noyau a une énergie plus faible que l’orbite la plus éloignée du noyau, qui a plus d’énergie.
- Les orbites ont un certain nombre d’électrons, selon leur distance au noyau. Cette échelle de distribution est appelée « configurations électroniques » et équivaut à l’échelle du tableau périodique (représentée dans l’ordre des lignes).
- Les électrons peuvent sauter de niveau ou d’orbite, et ce saut ne peut se produire que vers et depuis les orbites autorisées. Par exemple, un électron qui saute d’une orbite extérieure à une orbite intérieure perd de l’énergie, qui est émise sous la forme d’un photon, ou lumière . Si vous sautez d’une orbite intérieure à une orbite extérieure, vous gagnez de l’énergie.
- La quantité minimale d’énergie qui peut être gagnée ou perdue à n’importe quelle longueur d’onde est appelée « quantum d’énergie », d’où l’expression « saut quantique » pour désigner un changement d’électrons d’un niveau d’énergie à un autre. Ce changement est associé à une perte ou à un gain d’énergie.
Les principales contributions de Bohr
Le modèle de Bohr a été le premier à reconnaître le concept de mécanique quantique dans la structure électronique d’un atome d’hydrogène et, en outre, il a révélé à quoi ressemblait la stabilité des atomes .
La théorie classique soutenait qu’un électron (chargé négativement) en orbite autour d’un noyau (chargé positivement) émettait de l’énergie électromagnétique et ralentissait jusqu’à ce qu’il atterrisse sur le noyau.
Mais les tests expérimentaux n’ont pas montré le processus proposé par la théorie classique. En utilisant le modèle de Bohr et le travail de plusieurs autres physiciens, ils ont pu le comprendre.
En 1916, le physicien allemand Arnold Sommerfel a optimisé le modèle atomique de Bohr en ce qui concerne le fait que les électrons tournaient sur des orbites circulaires pour ajouter qu’ils pouvaient également tourner sur des orbites elliptiques plus complexes.
Au concept de mécanique quantique proposé par Bohr, le modèle quantique non relativiste du physicien autrichien Erwin Schrödinger a été ajouté en 1926, dont la théorie envisageait les électrons comme des ondes stationnaires de matière qui avaient une probabilité de se trouver à un certain endroit ou à un autre.
En 1927, les physiciens allemands Max Born et Werner Heisenberg ont contribué au concept de probabilité de Schrödinger, le principe d’incertitude, qui établissait que la position et la vitesse de l’électron ne pouvaient pas être connues simultanément. Par conséquent, sa trajectoire n’a pas pu être connue avec précision.
Grâce à ces contributions générales et à diverses études et théories d’autres physiciens et mathématiciens, il a été possible de résoudre le dilemme posé par la théorie classique qui était invérifiable à partir des tests expérimentaux.
Cela peut vous aider : Champ magnétique