Nous expliquons ce que sont les éléments chimiques, leur origine et leur classification. Aussi, quelles sont ses caractéristiques et quelques exemples.

Que sont les éléments chimiques ?
L’élément chimique est appelé matière composée du même type d’atome , c’est-à-dire atomiquement pur. Ce sont des substances qui ne peuvent pas être décomposées en substances plus simples par des réactions chimiques et qui sont classées dans le tableau périodique des éléments chimiques.
Les éléments ne doivent pas être confondus avec les substances simples , car dans certains cas, deux ou plusieurs atomes du même type peuvent être regroupés différemment. Par exemple, à partir d’ atomes d’ oxygène ( O), deux substances simples peuvent être composées : l’ozone (O 3 ) et l’oxygène moléculaire (O 2 ).
La plupart des éléments connus proviennent de la nature , où ils peuvent être trouvés monoatomiques ou en composés avec d’autres éléments. Certaines existent même artificiellement, grâce à l’inventivité de l’homme.
Selon l’élément dont il s’agit, il aura certaines propriétés et, par conséquent, différentes utilisations et applications.
Il ne faut pas non plus confondre les éléments chimiques avec les « quatre éléments » ( eau , feu , air , terre ) qui répondent à une ancienne classification des forces en jeu dans la nature.
Voir aussi: Séparation des mélanges
Origine des éléments chimiques
Les éléments chimiques se forment, à notre connaissance, à l’intérieur des étoiles , en tant que produit de processus complexes de fusion et de fission atomique qui génèrent des éléments de plus en plus lourds dans un processus appelé nucléosynthèse .
Nous supposons que c’est ainsi que toute matière dans l’ univers serait née , sauf celle que les êtres humains ont pu créer par eux-mêmes dans nos laboratoires et nos réacteurs nucléaires.
Nomenclature et représentation des éléments chimiques

Les éléments chimiques sont généralement baptisés avec des noms de la tradition mythologique gréco-romaine , comme le mercure , car de nombreuses théories sur l’origine et l’essence de l’univers que nous avons manipulées pendant des siècles proviennent de ces cultures .
Dans d’autres cas, cependant, un nom dérivé du nom de famille de son découvreur est généralement donné , comme c’est le cas avec le lawrencium, du nom de l’équipe de physiciens du Lawrence Berkeley National Laboratory qui l’a synthétisé pour la première fois.
Les éléments chimiques sont représentés par une ou une combinaison de lettres (acronymes) , qui résume le nom complet de l’atome, par exemple : oxygène (O), mercure (Hg) et lawrencium (Lr).
abondance d’éléments chimiques
Il existe actuellement 118 éléments chimiques connus , entre naturels et artificiels. Les premiers ont tendance à se trouver à l’état pur (comme l’hélium atmosphérique) ou à former des composés chimiques (comme le fer , rarement à l’état pur). Cela dépendra de la réactivité de l’élément et de ses affinités caractéristiques.
Les éléments artificiels sont généralement assez instables et libèrent souvent des quantités d’ énergie et de matière (radioactivité) dangereuses pour la santé. Ce processus de désintégration peut prendre des fractions de seconde, comme dans le cas de l’oganeson (Og), ou il peut prendre des centaines voire des millions d’années, comme dans le cas du plutonium (Pu).
Table périodique
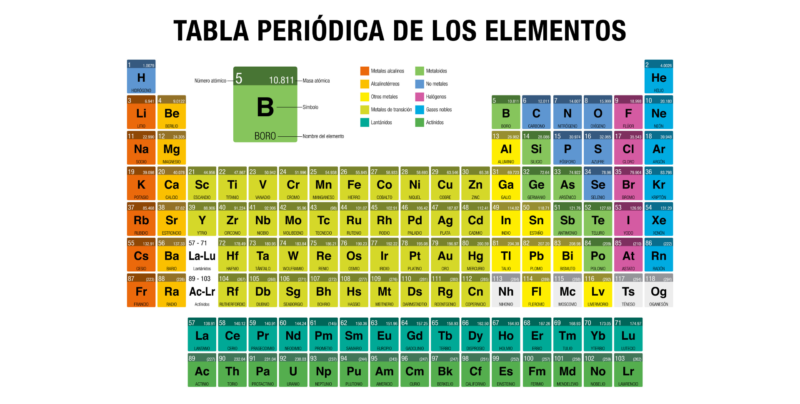
Le tableau périodique des éléments a été créé par Dmitri Mendeleïev en 1869 , pour ordonner visuellement les éléments chimiques connus en fonction de leurs propriétés et caractéristiques.
Aujourd’hui, après de nombreuses mises à jour et modifications, nous utilisons une nouvelle version contenant les éléments nouvellement synthétisés et servant d’outil pour l’étude atomique de la nature.
Classification des éléments chimiques
Les éléments chimiques peuvent être classés en fonction de leurs propriétés, distingués et organisés par le tableau périodique. En ce sens, on parle de :
- métaux . Ce sont des éléments solides à température ambiante (sauf le mercure), denses et très bons conducteurs de la chaleur et de l’électricité. Ils sont généralement brillants, c’est-à-dire qu’ils réfléchissent la lumière . Ils sont classés tour à tour en actinides, lanthanides, métaux de transition, alcalis , métaux alcalino-terreux et autres métaux.
- Pas les métaux . Ce sont des éléments qui ne sont pas de bons conducteurs de chaleur ou d’électricité et qui sont trop faibles pour être enroulés ou étirés comme c’est le cas avec les métaux. Ils sont pour la plupart indispensables aux systèmes biologiques (composés organiques).
- Métalloïdes . Ce sont des éléments qui correspondent à une classification intermédiaire entre métaux et non-métaux, et qui rassemblent les caractéristiques des deux groupes. Ils sont connus sous le nom de semi-métaux.
- halogènes . C’est un groupe de six éléments qui ont tendance à former des molécules diatomiques chimiquement très activesLes halogènes sont fortement oxydants, ces éléments sont donc souvent caustiques et corrosifs.
- gaz nobles . C’est un groupe de sept éléments dont l’état naturel est gazeux . Ils existent généralement sous leur forme monoatomique avec une très faible réactivité et pour cette raison ils sont également appelés gaz inertes. Ils partagent la plupart de leurs propriétés physiques et sont extrêmement stables.
Numéro atomique

Le numéro atomique est un nombre représenté par la lettre Z qui indique le nombre de protons présents dans le noyau des atomes d’un élément. Dans le tableau périodique, il est généralement présenté dans la partie supérieure gauche de la case de chaque élément.
Cette information est très importante en chimie et en physique quantique : rappelez-vous que les protons ont une charge positive et que les électrons ont une charge négative , donc le numéro atomique est utilisé pour comprendre (avec le nombre d’électrons) le comportement électromagnétique des atomes.
Masse atomique
La masse d’un atome équivaut à la somme du nombre de particules de son noyau : protons et neutrons.
Puisqu’un élément chimique a plusieurs isotopes (atomes du même élément chimique qui ont différents nombres de neutrons) avec différentes masses atomiques, la masse atomique d’un élément est généralement calculée comme la moyenne de tous ses isotopes connus.
Cependant, on sait aujourd’hui que cette procédure n’est pas tout à fait correcte car si l’élément possède l’un de ses isotopes en grande majorité, la masse calculée en moyenne se rapporterait principalement à la masse de l’isotope majoritaire. La manière stricte de calculer la masse d’un atome est de calculer la masse de l’isotope d’intérêt et non de faire la moyenne de la masse de tous les isotopes.
Valence

La valence est le nombre d’électrons qu’un atome d’un élément peut abandonner ou accepter pour compléter son orbite la plus externe (dernier niveau d’énergie).
Sur cette base, l’atome pourra former des liaisons covalentes , ioniques ou métalliques, partageant ou transférant ces électrons avec un autre atome. Certains atomes ont plus d’une valence, de sorte que ce concept est souvent appelé « nombre d’oxydation ».
isotopes

Les atomes d’un même élément peuvent varier entre eux, selon leurs propriétés nucléaires et énergétiques. Les atomes d’un même élément chimique qui se comportent différemment par rapport à leur noyau sont appelés isotopes . Les isotopes sont des atomes différents du même élément chimique mais qui ont le même nombre de protons et un nombre différent de neutrons dans leur noyau.
Par exemple, le plutonium est un élément radioactif, dont l’isotope plutonium-238 finit par devenir du plomb -206 ; mais son isotope ayant la plus longue durée de vie est le plutonium-244, avec une demi-vie (le temps qu’il faut à un noyau pour se désintégrer) de 80 millions d’années. En revanche, le plutonium-239 dure environ 24 100 ans et le plutonium-238 ne dure que 88 ans.
Exemples d’éléments chimiques
Les éléments chimiques les plus connus sont :
- Oxygène (O)
- Carbone (C)
- Hydrogène (H)
- Azote (N)
- Soufre (S)
- Fer (Fe)
- Cuivre (Cu)
- Or (Au)
- Argent (Ag)
- Mercure (Hg)
- Zinc (Zn)
- Hélium (He)
- Phosphore (P)
- Silicium (Oui)
- Sodium (Na)
- Lithium (Li)
- Calcium (Ca)
- Platine (Pt)
- Nickel (Ni)
- Chlore (Cl)
- Argon (Ar)
- Uranium (U)
- Fluor (F)
- Potassium (K)
- Néon (Ne)
- Arsenic (As)
- Chrome (Cr)
Il peut vous servir : Composés organiques