Nous expliquons ce qu’est le dioxyde de carbone et quelles sont ses caractéristiques générales. Aussi, ses propriétés, sa solubilité et plus encore.

Qu’est-ce que le dioxyde de carbone ?
Le dioxyde de carbone est un gaz obtenu comme produit final de nombreux procédés chimiques et biologiques . Sa concentration dans l’ atmosphère est plutôt faible, bien qu’elle ait beaucoup augmenté ces dernières années.
Le dioxyde de carbone est composé de deux atomes d’oxygène et d’un atome de carbone , sa formule chimique est donc CO 2 . Cette molécule a une géométrie linéaire et symétrique, la structure de Lewis qui la représente est : O=C=O.

Voir aussi : Hydrocarbures
Structure et formule du dioxyde de carbone

Comme son nom l’indique, le dioxyde de carbone est composé de deux atomes d’ oxygène et d’ un atome de carbone , sa formule chimique est donc CO 2 . La molécule de dioxyde de carbone a une géométrie linéaire et symétrique. Autrefois, on l’appelait aussi dioxyde de carbone ou dioxyde de carbone.
Caractéristiques du dioxyde de carbone
- Propriétés physiques . A température ambiante et pression atmosphérique, le dioxyde de carbone est un gaz incolore et inodore, mais il peut se solidifier s’il est exposé à des températures inférieures à -79°C, ainsi que se décomposer s’il est exposé à des températures élevées (supérieures à 2000°C).
- Solubilité et densité . Le dioxyde de carbone est bien soluble dans l’eau (chaque volume d’ eau dissout 0,9 volume de CO 2 ) et sa densité est de 1,976 kg/m 3 .
- Effet rafraîchissant . Le dioxyde de carbone sous sa forme solide (qui est obtenue par exposition à de basses températures) forme de la neige carbonique. Il s’agit d’un réfrigérant largement utilisé et efficace, qui lorsqu’il perd du froid ne se transforme pas en eau (comme la glace ordinaire) mais se transforme en gaz (car il est gazeux à la pression atmosphérique), ce qui tend à minimiser la contamination microbienne des produits frais. .
- Faible réactivité . Ce gaz n’est pas combustible et, en général, il n’est pas très réactif vis-à-vis d’autres substances, c’est pourquoi il est idéal pour une utilisation dans les extincteurs ou extincteurs domestiques. Étant gazeux, il est directement comprimé à l’intérieur de l’extincteur et ne nécessite aucun mécanisme de décharge supplémentaire. De plus, il ne conduit pas l’électricité , et pour cette raison, il est utilisé pour éteindre les incendies dans lesquels il existe un risque de choc électrique.
- acidité _ Le dioxyde de carbone dissous dans l’eau distillée a tendance à amener le pH de l’eau distillée à une valeur légèrement acide, en raison de la formation d’acide carbonique (H2CO3) d’abord, puis de l’ion bicarbonate (HCO 3 – ).

Comment se forme le dioxyde de carbone ?

Le dioxyde de carbone se forme à partir de divers processus, parmi lesquels se distinguent les suivants :
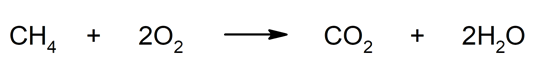
- combustion . La combustion de matières fossiles et non fossiles, comme le pétrole , le charbon, le gaz, produit du dioxyde de carbone. Par exemple : la combustion du méthane (CH 4 ).
- Fermentation . La fermentation des sucres effectuée par les bactéries et les levures conduit généralement à la formation d’acides et/ou d’alcools et de CO 2 . Par exemple : la fermentation alcoolique.

- Souffle . La respiration animale consiste à absorber de l’oxygène et à libérer du dioxyde de carbone. Par exemple : la respiration cellulaire.
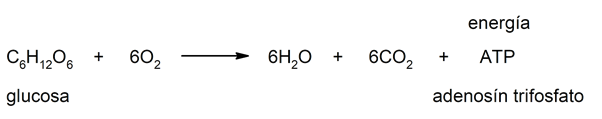
- Réaction des carbonates avec les acides . Certains sels , tels que les carbonates, peuvent réagir avec les acides pour former du dioxyde de carbone. Par exemple : réaction du carbonate de calcium (CaCO 3 ) et de l’acide chlorhydrique (HCl).
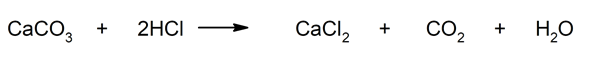
A quoi sert le dioxyde de carbone ?
La photosynthèse réalisée par les plantes et certains autres organismes photosynthétiques, comme les algues , nécessite du CO 2 , de sorte que ces êtres consomment une bonne partie du dioxyde de carbone de l’atmosphère terrestre.
La photosynthèse est un processus très important puisqu’elle tend à inverser en partie l’accumulation croissante de dioxyde associée à l’industrialisation des centres urbains .
Le dioxyde de carbone et l’effet de serre

L’effet de serre consiste en l’absorption du rayonnement thermique émis par la surface terrestre par certains gaz . Une partie de ce rayonnement thermique est ensuite renvoyée vers la terre, chauffant la surface plus qu’elle ne le devrait.
Les émissions de gaz, dont le dioxyde de carbone, ont augmenté de façon alarmante au cours du siècle dernier . On estime que la concentration de CO 2 dans l’atmosphère a augmenté de près de 100 ppm au cours des 150 dernières années.
Celle -ci est liée à l’augmentation de la température terrestre et à une série de dommages concomitants (fonte des calottes polaires, modifications de la végétation naturelle, modifications des espèces animales , etc.). La plupart des émissions de dioxyde de carbone proviennent de processus industriels (principalement de la combustion de combustibles fossiles) qui ont lieu dans les pays développés.
More in: Effet de serre