Nous expliquons ce qu’est le fer et quelles sont les propriétés de ce métal. En outre, ses caractéristiques et ses effets sur le corps.

Qu’est-ce que le fer ?
Le fer est un élément chimique de numéro atomique 26 et de poids atomique égal à 55 847 amu.Il est représenté par le symbole Fe dans le tableau périodique. C’est un métal gris argenté , très malléable et magnétique.
caractéristiques du fer

- C’est un métal dur, mais en même temps malléable.
- C’est très dense.
- Il existe dans la nature presque toujours dans le cadre de certains oxydes.
- Il a un éclat argenté métallique.
- En général, il est utilisé en combinaison avec d’autres éléments chimiques avec lesquels il forme des alliages.
Propriétés physiques du fer
- malléabilité _ Le fer est malléable, c’est-à-dire qu’il peut être déformé sans se casser et donc de fines couches de fer peuvent être réalisées.
- dureté . Sa dureté élevée le rend très résistant aux rayures par un autre.
- Haute densité . Un petit volume de fer a beaucoup de poids.
- Haute conductivité thermique . Le fer est utilisé comme composant principal des ustensiles de cuisine qui doivent être capables d’atteindre des températures élevées .
- Faible conductivité électrique . Comparé à d’autres métaux, le fer ne conduit pas très bien l’électricité , il n’est donc pas utilisé pour fabriquer des câbles ou des appareils électriques.
- Il a des propriétés magnétiques . Le magnétisme est un phénomène physique par lequel se produit l’attraction ou la répulsion que certains matériaux exercent sur d’autres, et le fer est le métal magnétique par excellence. Le fer, en général, n’est pas utilisé à l’état pur, à l’exception des cas où l’on veut profiter de ses propriétés magnétiques. Les autres métaux hautement magnétiques comme le fer sont le cobalt, le nickel et l’ acier doux , qui est un alliage de fer.
oxydation du fer

Le fer rouille lorsqu’il est exposé à :
Lorsqu’un matériau contenant du fer s’oxyde, ses couches superficielles se transforment en oxyde de fer. 16 types différents d’oxyde de fer sont connus , dont certains prennent une coloration spécifique.
Pour cette raison, les différents oxydes de fer ont été utilisés comme pigments dès les premières formes de peinture et se retrouvent dans des peintures rupestres millénaires.
Les principaux oxydes de fer sont :
- Oxyde de fer(II), FeO . C’est une poudre de couleur noire qui explose facilement.
- Oxyde de fer(III), Fe 2 O 3 . Il est de couleur rougeâtre. Cet oxyde est la rouille que l’on voit sur les objets métalliques contenant du fer lorsqu’ils sont exposés à l’humidité et à l’air pendant une longue période.
aciers

Les aciers sont un alliage de fer , c’est-à-dire une combinaison de fer et de carbone . La teneur maximale en carbone que l’acier peut avoir est de 2 %. Ils sont classés selon leur teneur en carbone :
- Acier à faible teneur en carbone . Contient moins de 0,25 %. Il est ductile et offre une grande résistance mécanique.
- Acier au carbone moyen . Contient entre 0,25% et 0,6%. Il est moins ductile mais plus résistant, c’est pourquoi il est utilisé dans des pièces mécaniques qui doivent résister à l’usure.
- Acier à haute teneur en carbone . Contient entre 0,6% et 1,4%. C’est un matériau très dur qui est utilisé dans les outils.
- Aciers alliés . En plus du carbone, un autre élément est ajouté qui lui confère une autre caractéristique physique. Un exemple est l’acier inoxydable qui, en plus du fer et du carbone, peut contenir du chrome et du nickel.
Continuer sur : Acier
Fer dans le corps humain
Le fer est un métal indispensable au fonctionnement de l’ organisme . L’hémoglobine et la myoglobine sont des protéines porteuses d’oxygène et toutes deux contiennent du fer dans leur molécule .
L’hémoglobine (présente dans les globules rouges) transporte l’oxygène dans le sang, tandis que la myoglobine (présente dans les muscles ) le stocke.
C’est pourquoi lorsqu’une personne n’a pas assez de fer dans son corps, elle peut se sentir fatiguée. La carence en fer est appelée anémie.
Bien qu’il soit nécessaire en petite quantité, un excès de fer peut être très nocif pour la santé . Si des vapeurs ou des poussières d’oxyde de fer sont inhalées de façon chronique, une maladie appelée sidérose peut se développer et le risque de développer un cancer du poumon peut être accru.
D’autre part, le contact direct du fer avec les yeux peut provoquer une conjonctivite , une choriorétinite et une rétinite.
Aliments contenant du fer

L’aliment qui contient la plus forte proportion de fer est la viande rouge et, dans une moindre mesure , le poisson , certains crustacés et le poulet.
Cependant, le fer peut également être obtenu à partir de sources non animales , telles que les noix, les graines et les légumineuses. Les légumes vert foncé (comme les épinards ou le brocoli) contiennent également des pourcentages élevés de fer.
effets environnementaux

L’alliage de fer appelé fer (III) – O – arsénite est dangereux pour l’environnement, affecte les végétaux et pollue l’air et l’eau . Cette substance ne peut pas être décomposée par les micro -organismes , elle reste donc dans l’environnement.
D’autre part, le fer est le matériau le plus recyclé au monde , ce qui réduit son accumulation dans l’ environnement .
formes allotropiques du fer
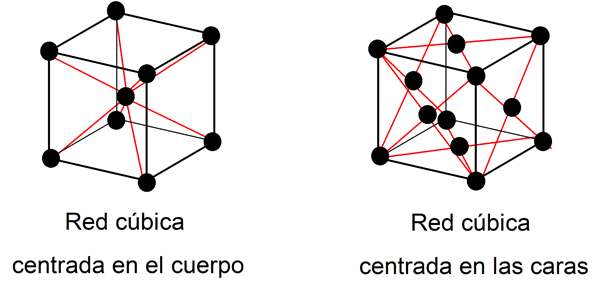
Le fer est un métal allotropique, c’est-à-dire qu’il change de structure en fonction de la température et de la pression dans laquelle il se trouve.
A la pression atmosphérique (1 atm) et à une température ne dépassant pas 900 °C, il présente une structure cristalline de type réseau cubique centré, c’est-à-dire avec les atomes de fer disposés dans une géométrie de cette forme. Si la température est plus élevée, jusqu’à environ 1400 °C, alors il a une structure cristalline de type réseau cubique à faces centrées. Mais si la température est encore plus élevée, jusqu’à 1540 °C, elle présente à nouveau une structure de type réseau cubique centré.
Continuer avec : Âge du fer







